|
|||||
|
|||||||
|
    An initiative of :

|
| Food-Info.net > Θέματα > Δομικές μονάδες των τροφίμων > Πρωτεϊνες Δομή των πρωτεϊνώνΟι ιδιότητες μιας πρωτεΐνης καθορίζονται από την αλληλουχία των αμινοξέων της, η οποία είναι αλλιώς γνωστή ως η πρωτοταγής δομή της. Ανάλογα με τη φύση και τη διευθέτηση των αμινοξέων μιας πρωτεΐνης, διαφορετικά τμήματα του μορίου της σχηματίζουν δευτεροταγές δομές όπως στην περίπτωση δημιουργίας άλφα ελίκων (κουλούρες) ή βήτα αλυσίδες (επίπεδες) που φαίνονται παρακάτω. Περαιτέρω αναδίπλωση και αναδιοργάνωση των δομών αυτών στο μόριο της πρωτεΐνης έχει ως συνέπεια την δημιουργία μίας ανωτέρας τάξης δομή, τη λεγόμενη τριτοταγή δομή . Κάθε πρωτεΐνη αποτελείται από άλφα έλικες, βήτα αλυσίδες και τυχαία τμήματα.
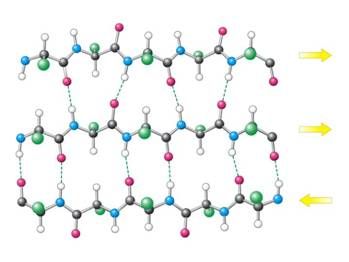 Σχ. 1 : Παράδειγμα βήτα αλυσίδας (τα βέλη δείχνουν την κατεύθυνση της αλυσίδας των αμινοξέων)
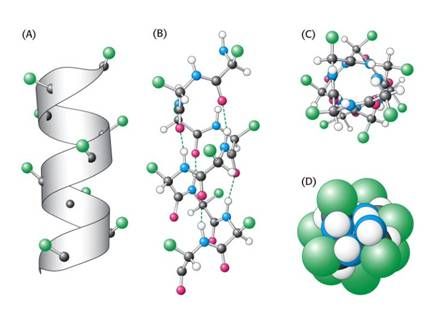 Σχ. 2 : Παράδειγμα άλφα έλικας. Α: σχεδιάγραμμα, B : μόριο, C : άνω όψη του μορίου, D : μοντέλο στο χώρο. Η δευτεροταγής και η τριτοταγής δομή αποτελεί την πιο σταθερή χωροδιάταξη (διαμόρφωση) του μορίου, και είναι το αποτέλεσμα μη-ομοιοπολικών αλληλεπιδράσεων (ιονικοί δεσμοί, δεσμοί υδρογόνου, υδρόφοβες αλληλεπιδράσεις) μεταξύ των διαφόρων πλευρικών αλυσίδων των αμινοξέων στο μόριο και των μορίων (νερού) που το περιβάλλουν. Διαφορετικά τμήματα της πρωτεΐνης, συχνά με διαφορετικές λειτουργίες, είναι δυνατό να αποτελούν δομικά διακριτές περιοχές . Περιοχές με συγγενικές δομές απαντούν σε διαφορετικές πρωτεΐνες που εκτελούν παρόμοιες λειτουργίες. Η εκτεθειμένη επιφάνεια της πρωτεΐνης είναι δυνατό να εμπλέκεται σε αλληλεπιδράσεις με άλλα μόρια, συμπεριλαμβανομένων άλλων πρωτεϊνών. Αλληλεπιδράσεις μεταξύ πρωτεϊνών, όπως για παράδειγμα μεταξύ των υπο-μονάδων των ενζύμων ή μεταξύ πολυμερών δομικών πρωτεϊνών έχουν ως συνέπεια το υψηλότερο επίπεδο οργάνωσης, την τεταρτοταγή δομή. ΜετουσίωσηΗ λειτουργία μιας πρωτεΐνης (με εξαίρεση την κατανάλωση της ως φαγητό) είναι άμεσα εξαρτώμενη από την τρισδιάστατη δομή της. Διάφοροι παράγοντες είναι δυνατό να αποδιοργανώσουν την δομή αυτή συντελώντας έτσι στην μετουσίωση της πρωτεΐνης.
Κανένας από τους παραπάνω παράγοντες δεν καταλήγει στη διάσπαση των πεπτιδικών δεσμών, έτσι η πρωτοταγής δομή της πρωτεΐνης σε γενικές γραμμές παραμένει αναλλοίωτη μετά τη μετουσίωση της. Ωστόσο, με την μετουσίωση οι πρωτεΐνες χάνουν τη λειτουργικότητα τους. Συχνά όταν μία πρωτεΐνη έχει υποστεί ήπια μετουσίωση και οι υπεύθυνοι παράγοντες για το φαινόμενο αυτό επανέλθουν στα φυσιολογικά επίπεδα (θερμοκρασία, pH , συγκέντρωση αλάτων κτλ.) είναι δυνατό να ανακτήσει την βιολογική της λειτουργία (π.χ. ενζυματική δραστηριότητα). Στα έτοιμα, μαγειρεμένα ή κονσερβοποιημένα τρόφιμα, οι περισσότερες πρωτεΐνες είναι μετουσιωμένες. Τα ένζυμα γενικά καταστρέφονται τελείως με το μαγείρεμα του φαγητού. Πηγές :
|
|
| ||||
| Food-Info.net is an initiative of Stichting Food-Info, The Netherlands | 
| |||||||