| Food-Info.net> Temas > Componentes básicos de los alimentos > Proteínas
Proteínas de Leche
La leche contiene cientos de tipos de proteínas, muchas de ellas en cantidades muy pequeñas. Las proteínas pueden ser clasificadas por varios caminos de acuerdo a sus propiedades físicas o químicas y sus funciones biológicas. Tradicionalmente las proteínas de leche fueron clasificadas en caseínas, proteínas de suero y proteínas menores. Las proteínas presentan glóbulos de grasa en la superficie y enzimas pertenecientes al grupo de proteínas menores.

Proteínas de suero es el término utilizado para proteínas de suero de leche, pero debería ser empleado únicamente para las proteínas del suero resultante de la fabricación de quesos. Adicionalmente el suero contiene fragmentos de moléculas de caseína que son separadas durante la coagulación enzimática del queso.
Los tres grupos principales de proteínas en leche están distribuidos por sus diferentes comportamientos y formas existentes. Las caseínas son fácilmente precipitables desde la leche principalmente por coagulación enzimatica o por disminución de pH, mientras que las proteínas de suero usualmente quedan en solución. Las proteínas globulares de suero denaturan bajo un calentamiento moderado mientras que las caseínas permanecen estables.

Caseina
Caseína es el nombre de un grupo de proteínas constituyente de las proteínas en leche. Las Caseínas están presentes en toda leche animal, incluyendo leche humana. En leche de vaca casi el 80% de las proteínas son caseínas, o alrededor de 26 g*l -1 de la leche.
Las Caseínas son divididas en cuatro sub-grupos caseina as-, as2-, ß- y ?. Las cuatro son muy heterogéneas y consisten de cada 2-8 variantes de genes diferentes. Estas variantes difieren entre sí solo por unos pocos aminoácidos. Caseínas a - y ▀ tienen en común que los aminoácidos están esterificados por acido fosfórico. Este ácido fosfórico une calcio (que es abundante en leche) para formar enlaces entre y dentro de las moléculas. Esto hace que las caseínas fácilmente formen varios polímeros con el mismo o diferente tipo de caseínas. Debido a la abundancia de grupos fosfatos y sitios hidrofóbicos en la molécula de caseína, las moléculas de polímeros formados por la caseína son muy especiales y estables. Los polímeros son construidos por cientos y miles de moléculas individuales y forman una solución coloidal que da el color blanco de la leche. Estas moléculas complejas son conocidas como miscelas de caseínas. Las Miscelas de caseína mostradas en la figura 1 consisten de un complejo de sub-miscelas de un diámetro de 10 a 15 nm (1 nanometro es igual a 10-9 m ). Un tamaño medio de miscelas consiste de alrededor de 400 a 500 sub-miscelas y pueden ser de un largo de 0.4 micrometros (0.0004 mm).
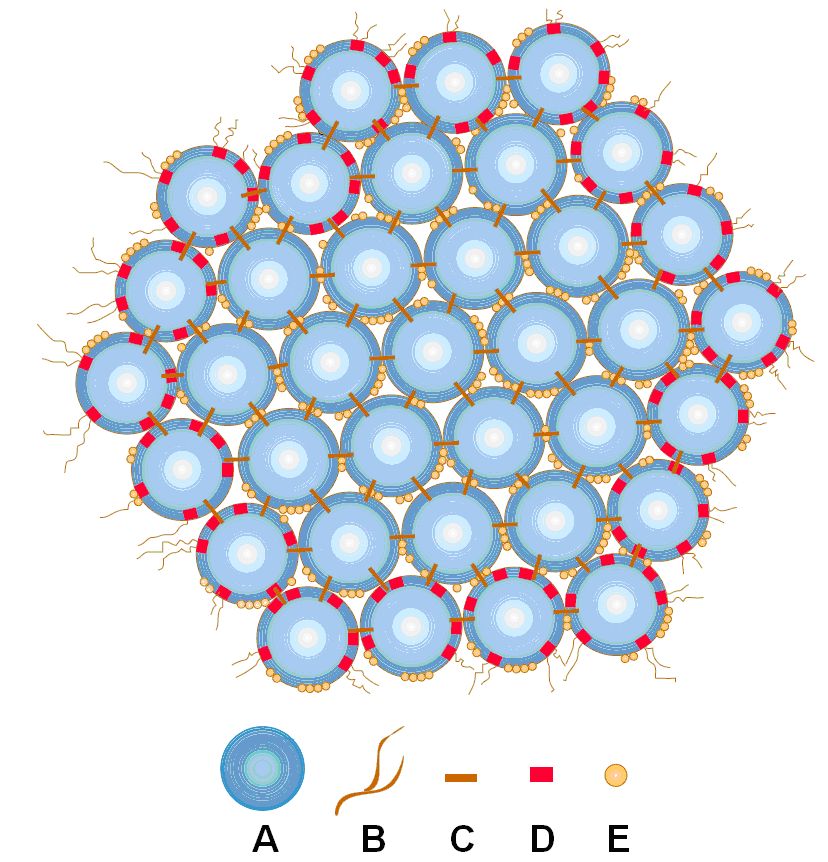
Figura 1 : A miscela de Caseina; A: una sub-miscela, B: cadena sobresaliente, C: fosfato de calcio, D: k-caseina, E: grupos fosfatos
El fosfato de calcio y las interacciones hidrofóbicas entre las sub-miscelas son responsables de la estabilidad de las miscelas de caseína. Las partes hidrofílicas de k-caseina contienen grupos de carbohidratos que se proyectan desde el exterior del complejo de miscelas (B en la figura) lo mas importante es que estabilizan las miscelas impidiendo la agregación.
La importancia de ?-caseina y estos grupos de carbohidratos se hace evidente en la fabricación de queso. La renina utilizada en la primera parte del proceso de fabricación de quesos desprende el carbohidrato de la superficie de las miscelas de ?-caseina. Así las miscelas perderán su solubilidad y comienzan a agregarse para formar un cuajo.
A baja temperatura la estructura de las miscelas es debilitada porque las cadenas de ?-caseina comienzan a disociarse, además de que el hidrofosfato de calcio deja la estructura de la miscela. La explicación de este fenómeno es que la ▀-caseína es la caseína más hidrofóbica y las interacciones hidrofóbicas son debilitadas cuando la temperatura es disminuida. La hidrólisis de ▀- caseína a ?-caseína y la proteasa-peptona (que rompen la estructura) significan una menor productividad de queso debido a que las fracciones de proteasa-peptona se pierden en el suero.
Otra enzima proteolítica puede también usarse para hacer cuajo, pero estos son quesos no específicos hechos sin renina, aunque contienen proteasas vegetales (para queso vegetariano) los que tienen un gusto diferente y entregan rendimientos de queso bajos.
Precipitacion por ácido
El pH disminuirá si el ácido es adicionado a la leche o si se permite el crecimiento de bacterias que producen ácido, en la leche. Cuando la leche que tiene un pH normal de alrededor de 6.5-6.7, es acidificada por varios procesos ocurrirá.
- En primer lugar el fosfato de calcio presente en la miscela de caseína se disolverá y formará iones de calcio que penetrarán la estructura de la miscelas y creará fuertes enlaces internos de calcio.
- En segundo lugar el pH de la solución se acercará al punto isoeléctrico de un tipo individual de caseína. El punto isoeléctrico es el punto en que la solubilidad de las caseínas es la más baja y se encuentra en el rango de pH 4.2 a 4.7.
Ambos métodos de acción inician un cambio dentro de las miscelas, comenzando con el crecimiento de las miscelas por agregación y finaliza con un pH más o menos de la solución densa coagulada. Estos procesos ocurren en leche fermentada. En leches fermentadas tal como yogurt la bacteria también produce polisacáridos que causan cremosidad del coagulado.
El ácido que precipitó la caseína se disuelve nuevamente si un gran exceso de hidróxido de sodio es adicionado. El caseinato de sodio resultante es utilizado como un ingrediente alimenticio principalmente por su excelente propiedad emulsificante. La estructura original de la miscela no puede ser restablecida por adición de hidróxido.

Proteinas de suero
Proteína de suero es el nombre comúnmente aplicado a proteínas de suero de leche, pero técnicamente solo contiene las proteínas presentes en suero, obtenida durante la fabricación de queso. Si la caseína es removida desde leche desnatada por adición de acido mineral, allí hay un grupo de restos de proteínas en solución que son llamadas proteínas de suero de leche. Estas son muy similares a las verdaderas proteínas de suero, de ahí el nombre común.
Proteínas de suero forman aproximadamente el 20% de la fracción de proteínas en leche. Las proteínas de suero son muy solubles y pueden ser separadas en los siguientes sub-grupos:
- a-lactoalbumina
- ▀-lactoglobulina
- Albumina de suero de sangre
- Immunoglobulinas
- Proteínas miscelaneas y polipéptidos
Proteínas de suero en general y a-lactoalbumina en particular tiene muy alto valor nutricional. Su composición aminoacídica está muy cerca del que es considerado como un grado óptimo biológico. Proteínas de suero derivadas son extensamente usadas en la industria de alimentos. Las proteínas de suero desnaturalizadas durante calentamiento causan la agregación de las proteínas de suero principalmente con las miscelas de caseína.
Las proteínas de suero son aisladas a una escala industrial por tecnología de membranas.
a-Lactoalbumina
Esta proteína puede ser considerada por ser la típica proteína de suero. Está presente en la leche de todos los mamíferos.
▀-Lactoglobulina
Esta proteína es encontrada solo en mamiferos (animales hoofed) y es el mayor componente de proteínas de suero en leche de vacas. Si la leche es calentada sobre 60°C, se inicia la desnaturalización donde la reactividad del aminoácido de azufre de la ▀ -lactoglobulin juega un rol importante. A altas temperaturas los componentes sulfurados son gradualmente liberados. Estos componentes sulfurados son en parte responsables de los sabores a cocido de la leche tratada con calor.
Inmunoglobulina
Las inmunoglobulinas juegan un rol importante en la protección del animal recién nacido (o humano) contra bacterias y enfermedades.
Lactoferrina
Lactoferrina es una glicoproteina que pertenece al transportador de fierro o la familia transferrina. Esto fue originalmente aislado desde leche bobina, pero está también presente en la leche de otros animales. Además se encuentra en las secreciones exocrinas de mamíferos.
La lactoferrina es considerada una proteína multifunctional o multi-tareas. Esta parece jugar varios papeles biológicos. Debido a sus propiedades de fierro obligatorias, lactoferrina, como se piensa, desempeña un papel en la respuesta de fierro por mucosa intestinal del lactante recién nacido. Esta también parece tener actividad antibacterial, antiviral, fungicida, antiflamatoria, antioxidante e immunomoduladora. Estas actividades están siendo estudiadas extensamente. Para ver una descripción y estudios corrientes http://www.lactoferrinresearch.org
Lactoperoxidasa
La lactoperoxidasa ha sido identificada como un agente antimicrobiano en la leche, la saliva y las lágrimas. La lactoperoxidasa es un sistema de defensa natural contra bacterias por la oxidación de iones tiocianato (SCN-) por el peróxido de hidrógeno. Estas están presentes en fluidos biológicos y junto con lactoperoxidasa son llamados los sistemas lactoperoxidasas (LP-s). LP-s tiene probado ambos efectos bactericida y bacteriostatico para una gran variedad de microorganismos, no teniendo efecto sobre las proteínas y enzimas de los organismos que lo producen.
Proteinas Menores.
Proteinas de la membrana
Las Proteínas de la membranas son un grupo de proteínas que forman una capa protectora alrededor de los glóbulos de grasa, para estabilizar la emulsión de gotitas de grasa en leche. Algunas de las proteínas contienen residuos de lípidos y son llamados lipoproteínas. Las proteínas globulinas de la membrana son la fracción mas pequeña de las proteínas en la leche, aproximadamente 1.5% de la fracción total de proteínas.
Los lípidos y los aminoácidos hidrofóbicos de aquellas proteínas hacen que las moléculas dirijan sus sitios hidrofóbicos hacia la superficie de grasa, mientras que las partes menos hidrófobas son orientadas hacia el agua. Enzimas fosfolipídicas y lipolíticas en particular son absorbidas dentro la estructura de la membrana.
Las Enzimas en la Leche
Las enzimas en la leche vienen igual desde el animal productor de leche o de las bacterias presentes en la leche. Estas, enzimas bacterianas, varían en el tipo y la abundancia según la naturaleza y el tamaño de la población bacteriana y no son consideradas aquí. Varias de las enzimas de la leche son utilizadas para pruebas de calidad y control. Entre las más importantes están peroxidasas, fosfatasas y lipasas.
Lactoperoxidasas
Las Peroxidasas transfieren oxigeno desde peroxido de hidrogeno (H2O2) a otras sustancias fácilmente oxidables. Esta enzima es inactivada si la leche es calentada a 80°C por unos pocos segundos, un hecho que puede ser usado para demostrar la presencia o la ausencia de peroxidasa en la leche y así comprobar si realmente una temperatura de pasteurización encima de 80 °C ha sido alcanzada. Esta prueba es llamada prueba peroxidasa Storch's.
Fosfatasa
La Fosfatasa tiene la propiedad y capacidad de dividir ciertos ésteres de acido fosfóricos en ácido fosfórico y sus alcoholes correspondientes. La presencia de fosfatasa en la leche puede ser detectada por adición de ésteres de ácido fosforico y un reactivo que cambia el color cuando reacciona con el alcohol liberado. Un cambio en el color revela que la leche contiene fosfatasa. Las fosfatasa es destruida por pasteurización ordinaria ( 72°C por 15-20 segundos) entonces la prueba de fosfatasa puede ser utilizada para determinar si la temperatura de pasteurización ha sido lograda.
Lipasa
Las Lipasas dividen la grasa en glycerol y ácidos grasos libres. Excesos de ácidos grasos libres en la leche y los productos de ésta dan lugar a un sabor rancio. La acción de estas enzimas parece en muchos casos ser muy débil, aunque la leche de ciertos animales puede mostrar fuerte actividad de lipasa. La cantidad de lipasa en la leche se cree que aumenta hacia el final del ciclo de lactancia. No ocurren reacciones entre la leche, las lipasas y la grasa mientras la superficie de los glóbulos de grasa permanecen intactos, pero en cuanto la superficie es destruida la enzima tiene la oportunidad para encontrar un sustrato y se liberan los ácidos grasos. Cuando la leche ha sido bombeada en frío con una bomba defectuosa o después de homogenización de leche fría sin pasteurización los ácidos grasos libres son formados inmediatamente. Los ácidos grasos y algunos otros productos de esta reacción enzimática dan una rancidez al producto.
Fuentes:
- Dairy Processing Handbook
- http://fst.osu.edu/People/HARPER/Functional-foods/Milk%20Components/Lactoperoxidase.html
|





