|




Een initiatief van :
Stichting Food-Info

|

|
Food-Info.net> Onderwerpen > Literatuurverslagen
Phenolische verbindingen in olijfolie als natuurlijke anti-oxidanten
Linda Kortenoeven
Literatuuronderzoek
Levensmiddelentechnologie
Wageningen Universiteit
Samenvatting
Lange tijd is al bekend dat olijfolie in verhouding met andere oliën veel stabieler is tegen oxidatie. Olijfolie is rijk aan phenolische verbindingen en deze worden geassocieerd met de stabiliteit.
Allereerst is er in dit literatuuronderzoek onderzocht welke phenolische verbindingen allemaal aanwezig zijn in olijfolie. Er zijn tot nu toe tientallen verbindingen gevonden. De grootste hoeveelheid wordt ingenomen door tyrosol en hydroxytyrosol. De andere verbindingen zijn slechts in kleine hoeveelheden aanwezig. De phenolische verbindingen in olijfolie hebben allemaal een benzeenring, met daaraan een hydroxylgroep. Verder hebben ze vaak nog extra hydroxylgroepen, die veresterd kunnen zijn met methylgroepen. Ook zit er nog een C1-C3 groep aan de benzeenring, in de vorm van een zuurgroep, ethanol, azijnzuur of propeenzuur.
Vervolgens is onderzocht wat de concentratie is van deze verbindingen. De totale gemeten concentratie varieert tussen de 200 en 500 ppm. De concentratie in de olie is onder andere afhankelijk van de gebruikte productiemethode, het soort, het klimaat en de rijpheid van de olijven. Ook de gebruikte analysemethode is van invloed op de gevonden concentratie.
Als derde is naar de anti-oxidatieve werking gekeken. De antioxidatieve activiteit is het grootst voor 3,4-DHPEA, 3,4-DHPEA-EDA en 3,4-DHPEA-EA, maar ook koffiezuur, hydroxytyrosol en vooral 3,4-dihydroxyphenylazijnzuur zijn goede anti-oxidanten. Tyrosol heeft nauwelijks een remmende werking op de oxidatie.
Ten slotte is de stabiliteit van de olie als gevolg van de phenolen onderzocht. De snelheid van het oxidatieproces is niet alleen afhankelijk van de hoeveelheid aanwezige anti-oxidanten, het hangt ook voor een groot deel af van de hoeveelheid vrije vetzuren in de olie. De peroxidevorming lijkt voor een groot deel door dit laatste te worden beslist. Bij de hexanalvorming zijn nog geen duidelijke resultaten verkregen. Geraffineerde olie kan dus langer houdbaar zijn dan vierge olijfolie doordat het percentage vrij oliezuur hier vaak lager is.
Inhoudsopgave
1 INLEIDING 4
2 DE VERSCHILLENDE PHENOLISCHE VERBINDINGEN 5
2.1 DE PHENOLISCHE VERBINDINGEN AANWEZIG IN OLIJVEN 5
2.2 DE PHENOLISCHE VERBINDINGEN AANWEZIG IN OLIJFOLIE 5
3 DE CONCENTRATIE 8
3.1 DE CONCENTRATIE VAN DE PHENOLISCHE VERBINDINGEN 8
3.2 INVLOED VAN DE OLIEPRODUCTIE OP DE CONCENTRATIE 9
3.3 ANDERE FACTOREN DIE VAN INVLOED ZIJN OP DE CONCENTRATIE 10
4 DE ANTI-OXIDATIEVE WERKING 11
4.1 DE ANTI-OXIDATIEVE ACTIVITEIT VAN DE AFZONDERLIJKE COMPONENTEN 11
4.2 ALGEMENE STRUCTUUR VOOR PHENOLISCHE ANTIOXIDANTEN 14
5 DE OXIDATIEVE STABILITEIT VAN DE VERSCHILLENDE OLIJFOLIËN 15
6 CONCLUSIE 17
LITERATUURLIJST 18
1 Inleiding
Olijfolie werd traditioneel vooral in het Middellands zeegebied geconsumeerd. De mensen worden echter steeds gezondheidsbewuster en vervangen verzadigd door onverzadigd vet. Dit heeft tot gevolg dat er meer oliën worden gebruikt. Langzaam aan wordt olijfolie dan ook wereldwijd geconsumeerd en gewaardeerd om zijn unieke en onderscheidende smaak.
Vetten zijn onderhevig aan oxidatie, waarbij ze reageren met zuurstof. Bij dit proces kunnen vluchtige verbindingen ontstaan, die ransheid veroorzaken. Een probleem is dat de onverzadigde vetten gevoeliger zijn voor oxidatie, waardoor oliën in het algemeen niet lang houdbaar zijn.
Lange tijd is echter al bekend dat olijfolie in verhouding met andere oliën veel stabieler is tegen oxidatie. Er wordt vermoed dat dit komt door de andere vetzuursamenstelling. Olijfolie bevat erg veel oliezuur, dus erg veel enkelvoudig onverzadigd vet. Andere oliën hebben veel meer meervoudig onverzadigd vet, wat veel gevoeliger is voor oxidatie. Ook is olijfolie rijk aan tocopherol en phenolische verbindingen, die worden geassocieerd met de stabiliteit. Deze verbindingen bezitten een anti-oxidatieve werking. Als anti-oxidanten zouden ze in staat zijn dit proces te remmen door de gevormde oxidatieproducten terug te reduceren. De phenolische verbindingen zijn ook verantwoordelijk voor de typische bittere smaak (Haumann, 1996).
Er zijn echter oliën die veel hogere gehaltes tocopherolen bevatten. Deze zijn echter allemaal minder stabiel. Een verklaring van de hoge stabiliteit zou dus kunnen worden gezocht in de aanwezigheid van de phenolische verbindingen.
In dit literatuuronderzoek is onderzocht welke verbindingen nu precies aanwezig zijn in olijfolie en in welke concentratie. Ook is er gekeken naar factoren die invloed hebben op de phenolconcentratie, met name het productieproces. Vervolgens zijn de anti-oxidatieve eigenschappen van deze verbindingen en de oxidatieve stabiliteit van de olie als gevolg van de aanwezigheid van deze anti-oxidanten bekeken.
2 De verschillende phenolische verbindingen
2.1 De phenolische verbindingen aanwezig in olijven
In olijven zijn de meeste phenolische componenten niet vrij, maar veresterd of veretherd met glucosides. Er is hoofdzakelijk oleuropeïne aanwezig. Andere verbindingen die zijn geïsoleerd uit olijven zijn demethyloleuropeïne, ligstroside, rutine, luteolin 7-glucoside, cornoside en verbascoside (Brenes et al., 1995). Deze componenten zijn oplosbaar in de waterfase, alleen hun aglycons zijn gedeeltelijk oplosbaar in olie (Angerosa et al., 1995).
Verder komen er ook hoeveelheden hydroxytyrosol voor, vrij of veresterd op één van de drie hydroxylgroepen. De geglycosyleerde verbindingen komen in gelijke hoeveelheden voor, wat duidt op een niet-regioselectief enzymatisch proces (Bianco et al., 1998).
In de olijven zijn slechts een klein aantal verschillende verbindingen aanwezig, terwijl er in de olie talrijke aanwezig zijn. Tijdens de rijping van het fruit en tijdens de productie van de olie treden er hydrolyse- en oxidatiereacties op door enzymen, zoals polyphenoloxidase, en door de lage pH van het milieu (Azodanlou, 1998). Verder is er in rijpe olijven b-glucosidase gevonden. Bij de oliepersing komt dit enzym vrij uit de pulp, waardoor de suikers worden afgesplitst (Bianco et al., 1998). Ook zorgt het tijdens de rijping al voor afbraak van oleuropeïne (Montedoro et al., 1993).
Zo wordt oleuropeïne gesplitst in hydroxytyrosol en elenolzuur, ligstroside in tyrosol en elenolzuur en verbascoside in koffiezuur en hydroxytyrosol (Azodanlou, 1998).
2.2 De phenolische verbindingen aanwezig in olijfolie
De phenolen in de olie maken deel uit van de zogenaamde polaire fractie. Deze worden meestal verkregen door met methanol/watermengsels te extraheren (Papadopoulos en Boskou, 1991).
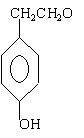
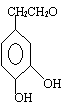
De grootste hoeveelheid van deze phenolen wordt ingenomen door tyrosol, gevolgd door hydroxytyrosol. Tyrosol is 4-hydroxyphenylethanol, hydroxytyrosol is 3,4-dihydroxyphenylethanol (Figuur 1) (Chimi et al., 1988).
|
|
Tyrosol (A) |
Hydroxytyrosol (B) |
Figuur 1: Tyrosol (A) en hydroxytyrosol (B) (Azodanlou, 1998)
Er zijn echter nog een heleboel andere verbindingen gevonden, die slechts in sporen voorkomen. Enkele andere verbindingen die vaak zijn gevonden zijn kaneelzuur, 3,4-dihydroxykaneelzuur (koffiezuur), 4-hydroxyphenylazijnzuur, 4-hydroxy-3,5-dimethoxybenzoëzuur (syringinezuur), 4-hydroxybenzoëzuur, 4-hydroxy-3-methoxybenzoëzuur (vanillinezuur), o-coumaarzuur, p-coumaarzuur en oleuropeïne (Papadopoulos en Boskou, 1991).
Montedoro et al. (1992) detecteerden de volgende stoffen in vierge olijfolie met behulp van HPLC: tyrosol, hydroxytyrosol, 3,4-dihydroxybenzoëzuur (protocatechinezuur), 4-hydroxybenzoëzuur, vanillinezuur, koffiezuur, syringinezuur, p-coumaarzuur, ferulazuur, o-coumaarzuur, oleuropeïne glycoside, oleuropeïne aglycon en kaneelzuur. Voor het eerst werd er ook elenolzuur gevonden. Dit is het afbraakproduct van oleuropeïne: elenolzuur veresterd met hydroxytyrosol. Elenolzuur is echter geen phenolische verbinding (Montedoro et al., 1992).
Verder werden er vier nieuwe verbindingen gevonden die met NMR konden worden geïdentificeerd. Alle vier de verbindingen zijn componenten van oleuropeïne en ligstroside, verbindingen die uit olijven zijn geïsoleerd. Eén is een isomeer van het oleuropeïne aglycon. De tweede is een oleuropeïne waarbij de elenolring is geopend, de vierde is ligtroside waarbij de elenolring is geopend. De vierde is een derivaat van tyrosol (Montedoro et al., 1993).
Een behandeling van de phenolen met zuur levert slechts erg kleine hoeveelheden galactose en glucose op; er zijn dus slechts sporen van geglycosyleerde verbindingen in de olie aanwezig (Litridou et al., 1997).
De phenolische verbindingen in olijfolie hebben allemaal een benzeenring, met daaraan een hydroxylgroep. Verder hebben ze vaak nog extra hydroxylgroepen, die veresterd kunnen zijn met methylgroepen. Ook zit er nog een C1-C3 groep aan de benzeenring, in de vorm van een zuurgroep, ethanol, azijnzuur of propeenzuur (Zambiazi en Przybylski, 1998).
Tot nu toe zijn er de volgende verbindingen in olijfolie gevonden (Tabel 1):
Tabel 1: De phenolische verbindingen aanwezig in olijfolie
Soort verbinding 1 |
Naam |
Triviale naam |
C6 – C1 |
4-hydroxybenzoëzuur |
|
|
3,4-dimethoxybenzoëzuur |
|
|
4-hydroxy-3-methoxybenzoëzuur |
vanillinezuur |
|
4-hydroxy-3,5-dimethoxybenzoëzuur |
syringinezuur |
|
3,4-dihydroxybenzoëzuur |
protocathechinezuur |
C6 – C2 |
4-hydroxyphenylazijnzuur |
|
|
4-hydroxy-3-methoxyphenylazijnzuur |
|
|
3,4-dihydroxyphenylazijnzuur |
|
|
4-hydroxyphenylethanol |
tyrosol |
|
3,4-dihydroxyphenylethanol |
hydroxytyrosol |
C6 – C3 |
kaneelzuur |
|
|
2-hydroxykaneelzuur |
o-coumaarzuur |
|
4-hydroxykaneelzuur |
p-coumaarzuur |
|
3,4-dihydroxykaneelzuur |
koffiezuur |
|
4-hydroxy-3-methoxykaneelzuur |
ferulazuur |
|
4-hydroxy-3,5-dimethoxykaneelzuur |
sinaptinezuur |
Derivaten |
elenolzuur veresterd met |
oleuropeïne aglycon |
|
Hydroxytyrosol |
oleuropeïne |
|
3,4-DHPEA-EA 1 |
isomeer van oleuropeïne |
|
3,4-DHPEA-EDA 2 |
dialdehyde vorm van oleuropeïne |
|
4-HPEA-EDA 3 |
dialdehyde vorm van ligstroside |
|
4-HPEA-derivaat 4 |
tyrosine-derivaat |
1. Limiroli et al., 1996; Montedoro et al., 1993
2. 3,4-DHPEA-EA = 4-dihydroxyphenylethanol-elenolzuur
3. 3,4-DHPEA-EDA = 3,4-dihydroxyphenylethanol-elenolzuurdialdehyde
4. 4-HPEA-EDA = 4-hydroxyphenylethanol-elenolzuurdialdehyde
5. 4-HPEA-derivaat = derivaat van 4-hydroxyphenylethanol
3 De concentratie
3.1 De concentratie van de phenolische verbindingen
De concentratie van de totale polyphenolen in olijfolie kan erg variëren en ligt meestal tussen de 200 en 500 ppm (Haumann, 1996).
Er zijn veel onderzoeken gedaan naar de gehaltes van de afzonderlijke phenolische componenten. Het hangt echter voor een groot gedeelte af van de analyse- en detectiemethode welke concentratie wordt gevonden (Tsimidou et al., 1992).
Montedoro et al. (1992) analyseerden 10 olijfoliën uit verschillende streken van Italië met behulp van HPLC. Baldioli et al. (1996) hebben 48 vierge olijfoliën uit Italië geanalyseerd op de phenolische verbindingen. Ze hebben beide dezelfde analysemethode gebruikt.
Dit leverde de volgende resultaten op (Tabel 2):
Tabel 2: De concentraties van de verschillende phenolen in olijfolie
Phenolische verbinding |
Concentratie 1 (ppm) |
Concentratie 2 (ppm) |
Gemiddelde concentratie 2 (ppm) |
Tyrosol |
2,82 – 11,3 |
0,0 – 25,4 |
4,5 |
Hydroxytyrosol |
1,39 – 5,56 |
0,1 – 123,1 |
25,7 |
Vanillinezuur |
0,56 – 2,26 |
0,0 – 0,8 |
0,2 |
Koffiezuur |
0,42 – 1,67 |
0,0 – 1,0 |
0,1 |
Siringinezuur |
0,41 – 1,66 |
0,0 – 2,3 |
0,5 |
p-coumaarzuur |
0,30 – 1,21 |
0,0 – 0,6 |
0,2 |
o-coumaarzuur |
0,30 – 1,19 |
|
|
Ferulazuur |
0,31 – 1,22 |
0,0 – 2,4 |
0,7 |
Oleuropeïne glycoside |
2,28 – 9,12 |
|
|
Kaneelzuur |
0,28 – 1,13 |
|
|
3,4-DHPEA-EDA |
spoor |
0,0 – 351,2 |
67,1 |
3-HPEA-EDA |
spoor |
0,0 – 79,8 |
25,6 |
3-HPEA derivaat |
spoor |
0,0 – 113,4 |
43,8 |
3,4-DHPEA-EA |
spoor |
0,0 – 83,5 |
27,7 |
1. Montedoro et al., 1992;
2. Baldioli et al., 1996
Montedoro en anderen (1992) hebben de laatste vier stoffen voor het eerst geanalyseerd. De concentratie van deze stoffen is echter niet gemeten. Het grootste gedeelte van de phenolische componenten wordt ingenomen door tyrosol, hydroxytyrosol en het oleuropeïneglycoside. Dit laatste is vreemd, omdat altijd is aangenomen dat deze laatste nauwelijks in olie voorkomt doordat het niet in olie oplosbaar is (Angerosa et al., 1995).
Uit het onderzoek van Baldioli et al. (1996) blijkt dat er een groot gedeelte van hydroxytyrosol (HDPEA) en tyrosol (HPEA) nog veresterd is met elenolzuur (EA) of een derivaat ervan (EDA). De gevonden hydroxytyrosolconcentratie is veel hoger, terwijl de andere componenten bijna alllemaal in een lagere concentratie zijn gevonden. Deze verschillen kunnen veroorzaakt zijn door een ander soort olijven of andere productiecondities (Baldioli et al., 1996).
3.2 Invloed van de olieproductie op de concentratie
Olijfolie kan op twee verschillende manieren worden gewonnen: door persing of door extractie.
Het persen is de traditionele manier. Vroeger werden de olijven met stenen kapot gemaakt, waarna ze met een hydraulische pers, zonder oplosmiddelen of heet water, werden geperst. De olie werd niet gefilterd of verder verwerkt (Haumann, 1996).
Tegenwoordig worden de olijven fijngemalen, waarna de pulp wordt gekneed en geperst (Haumann, 1996). De water- en oliefase worden van elkaar gescheiden met een verticale centrifuge (Manzi et al., 1998). Doordat de olie niet verder wordt verwerkt zijn er veel phenolen in de olie aanwezig (Haumann, 1996). Vaak wordt de pulp behandeld met heet water, wat tot verliezen van phenolen leidt (Papadopoulos en Boskou, 1991).
Afhankelijk van de zuurgehalte, dat is het percentage vrij vetzuur (voornamelijk oliezuur), wordt de olie ingedeeld. Olie met een percentage lager dan 1 %, wordt extra vierge olie genoemd. Olie met een zuurgehalte tussen de 1 en 3,3 % wordt vierge olie genoemd. Dit onderscheid zegt alleen iets over het percentage vrije vetzuren en dus over de oxidatiestabiliteit, maar dit zegt niets over de concentratie polyphenolen. Deze oliën waren vroeger de oliën van de eerste persing. Na de eerste persing werd er water aan de pulp toegevoegd, gemixt en weer opnieuw geperst. De olie die je dan kreeg had een erg hoge zuurgehalte en moest chemisch verder worden verwerkt. Tegenwoordig zijn er niet meer meerdere persingen (Haumann, 1996).
De geperste olie is echter erg duur, doordat het proces erg arbeidsintensief is. Ook kan olie met een zuurgehalte hoger dan 3,3 % niet zonder verdere chemische bewerking worden verkocht (Haumann, 1996).
De olie kan ook worden geëxtraheerd. Daarbij wordt de pulp verdund met water en geëxtraheerd met een horizontale centrifugale decanter. Ook hier wordt de olie van de waterfase gescheiden met een centrifuge (Manzi et al., 1998). De olie wordt verder chemisch bewerkt: gezuiverd (vrije vetzuren, koolhydraten en eiwitten verwijderen), gebleekt (ontkleuren), gedeodoriseerd (verwijderen van ongewenste geuren) en gefiltreerd. Daarbij gaat het aroma verloren. Zo ontstaat geraffineerde olijfolie. Olie die is geperst en een te hoge zuurgehalte heeft wordt ook verder verwerkt tot geraffineerde olijfolie. Deze olie bevat geen of bijna geen phenolen meer. Veel zijn er weggespoeld met de waterfase, doordat het grootste gedeelte beter wateroplosbaar dan olieoplosbaar is. Het resterende gedeelte gaat verloren met het filtreren en zuiveren (Haumann, 1996).
De geraffineerde olijfolie wordt echter bijna nooit puur verkocht, omdat deze nauwelijks smaak heeft en ook niet stabiel is tegen oxidatie door verwijdering van de antioxidanten. Meestal wordt het verkocht als een mengsel van geraffineerde olijfolie met vierge of extra vierge olie in een bepaalde verhouding (hoe hoger het percentage geperste olie, des te duurder), de zogenaamde pure olijfolie. De zuurgehalte moet lager zijn dan 1,5 %. De concentratie van de phenolen zal afhangen van de verhouding geraffineerd / (extra) vierge (Haumann, 1996).
Ook is er een “extra-light” olie op de markt gekomen. Dit is (pure) olijfolie waarvan de sterke geur en smaak is verwijderd (Haumann, 1996). De typische bittere olijfsmaak wordt veroorzaakt door de phenolische componenten (Azodanlou, 1998; Angerosa et al., 1995). Deze olie zal dus waarschijnlijk nog nauwelijks phenolen bevatten.
Het totale phenolgehalte is bepaald van een geraffineerde, gebleekte en gedeodoriseerde olie, een extra light olie, een pure olie en extra vierge olie (Tabel 3). De extra vierge olie is uit twee streken afkomstig. Dit leverde de volgende waarden op (Satue et al., 1995):
Tabel 3: Het totale phenolgehalte in verschillende soorten olijfolie
Soort olijfolie |
Concentratie 1 phenolen (ppm) |
Standdaarddeviatie(n = 2) |
Geraffineerd, gebleekt, gedeodoriseerd |
8,1 |
0,8 |
Extra light |
63 |
0,0 |
Puur |
81 |
2,1 |
Extra vierge (Spanje) |
534 |
23,9 |
Extra vierge (Californië) |
518 |
16,2 |
1. Satue et al., 1995
De verschillen zijn duidelijk zichtbaar. De extra vierge oliën hebben het grootste gehalte phenolen, de afkomst levert geen grote verschillen op. Geraffineerde olie heeft nog nauwelijks phenolen. De pure olie is een mensel van geraffineerde en vierge olie en zit er met de concentratie tussenin. De extra light olie heeft toch nog een groot gedeelte van de phenolen behouden (Satue et al., 1995).
Een ander onderzoek vond voor extra vierge olie 139,5 ppm en voor olijfolie (puur) 47,2 ppm (Gennaro et al., 1998).
3.3 Andere factoren die van invloed zijn op de concentratie
Andere factoren die invloed hebben op de concentratie van phenolische verbindingen zijn onder andere het soort olijven, het klimaat waarin ze gekweekt zijn en de rijpheid van de olijven (Angerosa et al., 1995).
Elke soort heeft een andere hoeveelheid van de verschillende componenten. Soms worden er ook componenten gevonden die in andere soorten niet aanwezig zijn (Limiroli et al., 1996).
Hoe rijper de olijven, des te lager is het polyphenolgehalte in de olie (Montedoro et al., 1993). Het donker worden van de olijven wordt veroorzaakt door een polymerisatie van de phenolen. Deze phenolen zullen dan minder snel in de olie terechtkomen (Brenes et al., 1990).
4 De anti-oxidatieve werking
4.1 De anti-oxidatieve activiteit van de afzonderlijke componenten
Eén van de eerste onderzoeken werd gedaan door Chimi et al. in 1988. Daarbij werd de anti-oxidatieve werking van vier phenolische componenten vergeleken met BHT (butyl-hydroxytolueen), een synthetische anti-oxidant. De stoffen werden in verschillende concentraties (50, 100 en 200 ppm) aan een olijfolie zonder phenolische verbindingen toegevoegd. Het verloop van de auto-oxidatie werd gevolgd door het peroxidegetal en de extinctie bij 232 nm te meten na incubatie bij een temperatuur van 50°C. Tyrosol bleek geen enkel beschermend effect tegen de oxidatie te hebben, oleuropeïne een beetje. Koffiezuur bleek 1,5 maal zo goed te werken als BHT en hydroxytyrosol zelfs meer dan 2 maal zo goed. De gevonden volgorde: hydroxytyrosol > koffiezuur > BHT > oleuropeïne > tyrosol (Chimi et al., 1988).
Verder onderzoek werd gedaan door Papadopoulos en Boskou in 1991. Zij voegden 200 ppm van een aantal phenolische componenten afzonderlijk toe aan geraffineerde olijfolie. Het peroxidegetal werd gemeten en vergeleken met een blanco olie zonder phenolische verbindingen. Het peroxidegetal geeft de hoeveelheid hydroperoxides, het primaire oxidatieproduct weer. Met de gevonden resultaten kon de beschermingsfactor bij een peroxidegetal van 20 en van 70 worden uitgerekend. Daarbij werd de tijd die nodig was voor de olie met een bepaald phenol om dat peroxidegetal te bereiken gedeeld door de tijd voor de blanco olie. Hoe hoger het getal, des te beter is de werking (Papadopoulos en Boskou, 1991). Dat leverde de volgende resultaten op (Tabel 4):
Tabel 4: De beschermingsfactor (BF) tot het bereiken van een peroxidegetal van 20 en 70 voor verschillende phenolische verbindingen
Phenolische verbinding |
BF20 |
BF70 |
Vanillinezuur |
1,0 |
1,0 |
o-Coumaarzuur |
1,0 |
1,1 |
p-Coumaarzuur |
1,2 |
1,1 |
Tyrosol |
1,2 |
1,1 |
4-Hydroxybenzoëzuur |
1,3 |
1,1 |
4-Hydroxyphenylazijnzuur |
1,3 |
1,2 |
Syringinezuur |
1,5 |
1,4 |
Protocathechinezuur |
2,7 |
2,3 |
BHT |
4,4 |
3,8 |
Koffiezuur |
5,7 |
5,2 |
Hydroxytyrosol |
15,2 |
9,5 |
3,4-Dihydroxyphenylazijnzuur |
> 18,4 |
> 10,6 |
1. Papadopoulos en Boskou, 1991
Ook hier heeft tyrosol nauwelijks een beschermende werking. Tyrosol is het belangrijkste phenol in olijfolie (Papadopoulos en Boskou, 1991). Dit verklaart waarom sommige auteurs geen proportionele correlatie vinden tussen de totale hoeveelheid phenolen en de oxidatieve stabiliteit van de olijfolie (Chimi et al., 1988).
Koffiezuur, hydroxytyrosol en vooral 3,4-dihydroxyphenylazijnzuur zijn erg goede antioxidanten, zelfs beter dan BHT (Papadopoulos en Boskou, 1991).
Satue et al. (1995) onderzochten de anti-oxidatieve activiteit van phenolen in geraffineerde olijfolie door ze elk afzonderlijk in verschillende concentraties aan de olie toe te voegen en het peroxidegetal en de hexanalvorming te meten. Hexanal is een secundair oxidatieproduct. Verder werd de werking van de phenolen vergeleken met een phenolisch extract van vierge olijfolie en met a-tocopherol (Tabel 5).
De remming kan worden uitgerekend: (B-M)/M = Remming
B = peroxidegetal of hexanalvorming bij blanco
M = peroxidegetal of hexanalvorming bij monster (Satue et al., 1995)
Tabel 5: Het percentage remming voor verschillende phenolische verbindingen op basis van het peroxidegetal en de hexanalvorming 1
Monster |
Concentratie (ppm) |
% Remming op basis van het peroxidegetal |
% Remming op basis van de hexanalvorming |
Dag 3 |
Dag 11 |
Dag 15 |
Dag 3 |
Dag 11 |
Dag 15 |
Phenolisch extract |
50 |
44,4 |
54,2 |
52,4 |
50,8 |
-19,9 |
28,8 |
100 |
41,1 |
18,0 |
9,0 |
100,0 |
69,0 |
76,2 |
200 |
55,9 |
27,0 |
3,5 |
65,2 |
58,0 |
77,9 |
p-Coumaarzuur |
50 |
42,6 |
35,7 |
38,9 |
32,6 |
17,4 |
37,5 |
100 |
46,7 |
31,5 |
34,5 |
51,1 |
27,0 |
47,1 |
Koffiezuur |
50 |
49,4 |
52,3 |
47,0 |
100,0 |
78,5 |
89,6 |
100 |
38,7 |
54,0 |
52,0 |
100,0 |
82,4 |
90,4 |
Vanillinezuur |
50 |
27,9 |
28,2 |
22,6 |
100,0 |
64,3 |
73,8 |
100 |
63,4 |
38,5 |
33,8 |
100,0 |
50,6 |
20,8 |
Kaneelzuur |
50 |
29,0 |
24,9 |
27,7 |
100,0 |
59,4 |
73,1 |
100 |
-47,2 |
8,8 |
21,0 |
63,6 |
62,1 |
77,5 |
o-Coumaarzuur |
100 |
84,2 |
21,1 |
28,2 |
100,0 |
45,7 |
63,9 |
500 |
47,8 |
23,4 |
6,0 |
100,0 |
-1,7 |
32,4 |
Ferulazuur |
100 |
85,2 |
34,4 |
40,1 |
100,0 |
62,4 |
81,2 |
500 |
66,8 |
33,3 |
36,8 |
100,0 |
65,3 |
82,7 |
a-Tocopherol |
100 |
80,8 |
0,4 |
0,3 |
100,0 |
90,6 |
95,3 |
500 |
65,3 |
-174,1 |
-158,9 |
100,0 |
51,8 |
75,9 |
1. Satue et al., 1995
Het phenolische extract lijkt, als je naar het peroxidegetal kijkt, beter te werken bij 50 ppm, dan bij 100 of 200 ppm. Bij de hexanalvorming zijn de phenolen echter betere antioxidanten bij 100 en 200 ppm dan bij 50 ppm (Satue et al., 1995).
Gebaseerd op het peroxidegetal kunnen de phenolische componenten als volgt worden geordend in afnemende activiteit bij 100 ppm: koffiezuur > ferulazuur = p-coumaarzuur = vanillinezuur = o-coumaarzuur > kaneelzuur > phenolisch extract > a-tocopherol. De monophenolen (o- en p-coumaarzuur) en de nonphenolen (kaneelzuur) lijken het beste bij de laagste concentratie te werken. De o-diphenolen daarentegen werken bij allebei de concentraties erg goed. a-Tocopherol was het minst effectief en was een pro-oxidant bij een concentratie van 500 ppm (Satue et al., 1995).
Gebaseerd op de hexanalvorming bij 100 ppm kunnen de verbindingen als volgt worden geordend: a-tocopherol > koffiezuur > ferulazuur = kaneelzuur = phenolisch extract > o-coumaarzuur > vanillinezuur > p-coumaarzuur. Koffiezuur toonde geen duidelijk verschil tussen 50 en 100 ppm, maar vanillinezuur was beter bij 50 ppm. De monophenolen en nonphenolen werken beter bij een concentratie van 100 ppm. a-Tocopherol is een erg goede remmer van hexanalvorming bij hoge concentraties (Satue et al., 1995).
Uit deze resultaten blijkt dat het belangrijk is dat er bij een onderzoek meerdere methodes worden gebruikt. Vooral a-tocopherol geeft twee totaal verschillende resultaten (Satue et al., 1995).
Algemeen kan worden geconcludeerd dat vooral de o-diphenolen een goede antioxidatieve activiteit bezitten. Koffiezuur had de hoogste activiteit voor hydroperoxidenremming en hexanalremming bij de geteste concentraties. Ferulazuur was ook een goede antioxidant. Vanillinezuur, dat er precies hetzelfde uitziet als ferulazuur maar een benzoëzuurgroep in plaats van een kaneelzuurgroep heeft, was een goede antioxidant bij de hexanalremming. Het lijkt dat derivaten van kaneelzuur betere antioxidanten zijn dan de corresponderende benzoëzuurderivaten, vooral in de afbraak van hydroperoxides. De nonphenolen hebben een betere antioxidatieve werking dan de monophenolen (Satue et al., 1995).
Gennaro heeft met thermogravimetrische analyses (TGA) de antioxidatieve activiteit van een aantal phenolen onderzocht. Hierbij werd de olie, waar een bepaald phenol aan was toegevoegd, langzaam verhit in een zuurstofrijke omgeving, terwijl de gewichtstoename werd bepaald. Als er een vetzuur met zuurstof reageert, zal dit tot gewichtstoename leiden. Zo kon er een schatting worden gemaakt van de activiteit van het toegevoegde phenol. Vooral oleuropeïne, 3,4-DHPEA en 3,4-DHPEA-EA hadden een hoge activiteit. Koffiezuur en BHT bleken geen goede oxidatieremmers te zijn. Dit in tegenstelling tot eerdere resultaten. Oleuropeïne had hier ook een vele betere activiteit dan bij al eerder gevonden resultaten (Chimi et al., 1988). De manier van onderzoeken is echter totaal anders, wat vergelijken moeilijk maakt (Gennaro et al., 1998).
Baldioli en anderen hebben in 1996 geprobeerd de totale hydrofiele phenolen en een heleboel afzonderlijke phenolen te correleren met de oxidatieve stabiliteit van olijfolie. Het totale phenolisch extract had een erg goede correlatie (r = 0,97). Verder hadden 3,4-DHPEA-EDA en 3,4-DHPEA-EA ook een erg goede correlatie. Ook hier hadden tyrosol en p-HPEA een lage antioxidatieve activiteit. a-Tocopherol toonde nauwelijks correlatie (r = 0,05) (Baldioli et al., 1996).
De onderzoeken tot nu hebben zich alleen gericht op de antioxidatieve werking van de afzonderlijke verbindingen. De combinatie van verbindingen kan echter een remmend of juist een stimulerend effect hebben op de activiteit. Baldioli en anderen (1996) hebben hiernaar als één van de weinigen onderzoek gedaan. Er werd de synergistische werking van a-tocopherol met 3,4-DHPEA, 3,4-DHPEA-EDA en 3,4-DHPEA-EA onderzocht. Daarbij werden concentraties van 0,10 en 0,25 mM gebruikt. Vooral bij 0,10 mM heeft a-tocopherol een versterkende werking (± 50 %), terwijl bij 0,25 mM er een stijging was van ± 15 % (Baldioli et al., 1996).
De antioxidatieve activiteit van de simpele phenolische verbindingen is al vaak onderzocht. De som van de simpele phenolen correleert echter niet goed met de geobserveerde stabiliteit van vierge olijfolie, terwijl de totale polyphenolen wel een hoge correlatiecoëfficiënt geven. Daarom is er een onderzoek gedaan waarbij de polaire fractie van vierge olijfolie in twee fracties werd verdeeld. Fractie A bevatte alleen simpele phenolen en phenolzuren, terwijl fractie B complexe verbindingen had. Fractie B is verder geanalyseerd met zure en alkalische hydrolyse. Bij de zure hydrolyse kwam vooral hydroxytyrosol en tyrosol vrij, terwijl de alkalische hydrolyse alleen tyrosol vrijmaakte. Dit zouden onder andere 3,4-DHPEA-EDA, 3,4-DHPEA-EA en 4-HPEA-EA kunnen zijn (Montedoro et al., 1993). Fractie B bleek meer polyphenolen en o-diphenolen dan fractie A te bevatten. De antioxidatieve werking van de phenolen was in fractie A beter dan in fractie B. Maar doordat de concentratie van de phenolen in fractie B hoger is, zullen beide een rol spelen voor de stabiliteit (Litridou et al., 1997).
4.2 Algemene structuur voor phenolische antioxidanten
Aan de hand van de gevonden resultaten kan er een algemene structuur voor actieve phenolische antioxidanten worden opgesteld: minstens twee naast elkaar gelegen hydroxylgroepen en een carbonylgroep in de vorm van een aromatische ester, lacton, chalcon, flavanon of flavon zijn essentieel. Monophenolen kunnen ook een goede activiteit hebben. Deze activiteit neemt toe als er één of twee methoxygroepen op de ortho-positie (ernaast) op de phenolring aanwezig zijn. De aanwezigheid van dezelfde groep op de para-positie (tegenover) zorgt voor een betere effectiviteit dan die van de carboxylgroep in benzoëzuur (Zambiazi en Przybylski, 1998).
Het antioxidatieve mechanisme voor phenolische componenten is onder andere het wegvangen van peroxylradicalen (ROO•) in de propagatiestap die leidt tot de formatie van hydroperoxides. Ze zijn ook in staat verdere afbraak van hydroperoxides te remmen door met alkoxylradicalen (RO•) te reageren, die verantwoordelijk zijn voor het ontstaan van vluchtige verbindingen zoals hexanal (Satue et al., 1995).
Phenolische verbindingen zijn in staat op twee manieren peroxylradicalen weg te vangen:
ROO• + ArOH -> ROOH + ArO• (I)
ROO• + ArO• -> ROO – ArO (II)
Er zijn echter nog meer reacties waar je rekening mee moet houden als je naar de oxidatieremming wilt kijken:
ArO• + ROOH -> ROO• + ArOH (III)
2 ArO• -> niet radicale producten(IV)
ArO• + RH -> ArOH + R• (V)
Voor sterische gehinderde phenolen zijn de snelheden van reacties II en IV veel groter dan van de reacties III en V. Daardoor worden peroxylradicalen en alkoxylradicalen aan de ketenreactie onttrokken. Sterisch gehinderde phenolen zijn dus goede antioxidanten. Bij tyrosol echter, is er geen hinder en daarom wordt aan reacties III en V de voorkeur gegeven. Hierdoor ontstaan er juist veel peroxylradicalen. Tyrosol heeft dan ook nauwelijks een beschermende werking (Chimi et al., 1991).
5 De oxidatieve stabiliteit van de verschillende olijfoliën
Het is natuurlijk interessant dat er meer phenolen in de vierge olie zitten, maar het is de vraag of deze olie ook echt stabieler is tegen oxidatie. Voor dit onderzoek werden vijf soorten olijfoliën onderzocht: geraffineerde, gebleekte en gedeodoriseerde olie, extra light olie, pure olie, extra vierge olie uit Spanje en extra vierge olie uit Californië. Daarvan werd het totale phenolgehalte, het percentage vrij oliezuur, het peroxidegetal en de hoeveelheid hexanal bepaald (Tabel 6). De vijf monsters werden bij 60ºC gezet en gedurende twaalf dagen werd het peroxidegetal en de hexanalvorming bepaald (Figuur 2) (Satue et al., 1995).
Tabel 6: De concentratie phenolen, concentratie vrije vetzuren, het peroxidegetal en de hoeveelheid hexanal van de verschillende olijfoliën op dag 0 (Satue et al., 1995)
|
Geraffineerd |
Extra light |
Puur |
Extra vierge (Spanje) |
Extra vierge (Californië) |
Totale phenolen (ppm) |
8,1 |
63,4 |
81,2 |
534,4 |
518,1 |
Vrije vetzuren (% oliezuur) |
0,0 |
0,1 |
0,3 |
0,3 |
0,5 |
Peroxidegetal |
0,4 |
11,0 |
12,7 |
15,6 |
32,5 |
Hexanal (mmol/kg) |
0,1 |
0,2 |
0,3 |
0,3 |
1,0 |
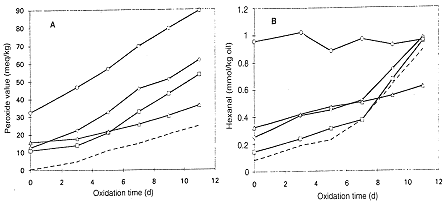
Figuur 2: De oxidatieve stabiliteit van commerciële olijfoliën bij 60°C (Satue et al., 1995)
A: het peroxidegetal (n=2)
B: de hexanalvorming (n=2).
(-----) = geraffineerde, gebleekte, gedeodoriseerde olijfolie, (--) = extra light olijfolie, (-G-) = pure olijfolie, (-D-) = extra vierge olijfolie uit Spanje, (-O-) = extra vierge olijfolie uit Californië
Op basis van het peroxidegetal zijn die oliën het stabielst die het laagste peroxidegetal op dag 0 hebben. Ondanks dat de vierge oliën veel polyphenolen bevatten, 518 en 534 ppm, zijn ze toch duidelijk minder stabiel dan de geraffineerde olie die slechts 8 ppm phenolen heeft. De grotere oxidatieve stabiliteit van de vierge olie uit Spanje in vergelijking met de vierge olie uit Californië kan worden verklaard door het lagere begin peroxidegetal en minder vrije vetzuren. Het is duidelijk dat de antioxidantactiviteit in de vierge oliën wordt verminderd door hun hoge peroxidegetal in het begin (Satue et al., 1995).
Op basis van de hexanalvorming zijn de oliën moeilijk te vergelijken, doordat er grote verschillen zijn in de hexanalconcentratie op dag 0. De geraffineerde olie had de laagste begin hexanalconcentratie, die na een inductieperiode van 5 dagen steeg. De pure olijfolie en de extra light olie hadden een inductieperiode van 7 dagen. De extra vierge olie uit Spanje toonde geen inductieperiode. De erg hoge hexanalconcentratie in het begin van de extra vierge olie uit Californië bleef constant tijdens de oxidatie, er was blijkbaar een maximale waarde bereikt. Ondanks dat alle oliën een hogere of gelijke initiële hexanalconcentratie dan de geraffineerde olie hadden, was na 11 dagen bij de extra vierge olie uit Spanje de hexanalconcentratie duidelijk lager geworden, terwijl bij de anderen de hexanalconcentraties niet significant anders waren (Satue et al., 1995).
6 Conclusie
Er zijn tot nu toe tientallen phenolische verbindingen in olijfolie gevonden. De grootste hoeveelheid wordt ingenomen door tyrosol en hydroxytyrosol. De andere phenolen zijn slechts in kleine hoeveelheden aanwezig.
De totale gemeten concentratie varieert tussen de 200 en 500 ppm. De concentratie in de olie is onder andere afhankelijk van de gebruikte productiemethode, het soort, het klimaat en de rijpheid van de olijven. Ook de gebruikte analysemethode is van invloed op de gevonden concentratie.
De antioxidatieve activiteit is het grootst voor 3,4-DHPEA, 3,4-DHPEA-EDA en 3,4-DHPEA-EA, maar ook koffiezuur, hydroxytyrosol en vooral 3,4-dihydroxyphenylazijnzuur zijn goede anti-oxidanten. Tyrosol heeft nauwelijks een remmende werking op de oxidatie.
De snelheid van het oxidatieproces is echter niet alleen afhankelijk van de hoeveelheid aanwezige anti-oxidanten, het hangt ook voor een groot deel af van de hoeveelheid vrije vetzuren in de olie. De peroxidevorming lijkt voor een groot deel door dit laatste te worden beslist. Bij de hexanalvorming zijn nog geen duidelijke resultaten verkregen. Geraffineerde olie kan dus langer houdbaar zijn dan
vierge olijfolie doordat het percentage vrij oliezuur hier meestal veel lager is.
In de toekomst zal er nog veel onderzoek moeten worden gedaan. Allereerst zijn nog lang niet alle verbindingen bekend. Verder is een synergistische werking tussen de verschillende verbindingen nog nauwelijks onderzocht. Ook kunnen er zich in de olijfolie nog andere stoffen bevinden die een remmend of juist stimulerend efffect op de werking hebben. Verder zou het nuttig zijn onderzoek te doen naar de mogelijkheden om olijfolie met een laag vrij vetzuurgehalte en een hoog phenolgehalte te produceren. Tenslotte zou er onderzoek gedaan kunnen worden naar de mogelijkheden om de phenolen uit de olijven of uit de afvalstromen te isoleren en aan andere oliën toe te voegen.
Literatuurlijst
Angerosa, F.; d'Alessandro, N.; Konstantinou, P.; Di Giacinto, L. GC-MS Evaluation of Phenolic Compounds in Virgin Olive Oil. J. Agric. Food Chem. 1995 , 43 , 1802-1807.
Azodanlou, R. Identification et Quantification des Gallates dans les Huiles d'Olive et les Beurres, par la Chromatographie sur Couche Mince. Trav. Chim. Aliment. Hyg. 1998 , 89 , 355-368.
Baldioli, M.; Servilli, M.; Peretti, G.; Montedoro, G. F. Antioxidant Activity of Tocopherols and Phenolic Compounds of Virgin Olive Oil. J. Am. Oil Chem. Soc. 1996 , 73 (11) 1589-1593.
Bianco, A.; Mazzei, R. A.; Melchioni, C.; Romeo, G.; Scarpati, M. L.; Soriero, A.; Uccella, N. Microcomponents of Olive Oil-III. Glucosides of 2(3,4-dihydroxy-phenyl)ethanol. Food Chem. 1998 , 63 (4), 461-464.
Brenes, M.; Montano, A.; Garrido, A. Ultrafiltration of Green Table Olive Brines: Influence of Some Operating Parameters and Effect on Polyphenol Composition. J. of Food Sc . 1990 , 55 (1), 214-217.
Brenes, M.; Rejano, L.; García, P.; Sánchez, A. H.; Garrido, A. Biochemical Changes in Phenolic Compounds during Spanish-Style Green Olive Processing. J. Agric. Food Chem. 1995 , 43 , 2702-2706.
Chimi, H.; Sadik, B.; Rahmani, M. Contribution à l'Etude Comparative des Pouvoirs Antioxydants dans l'Huile d'Olive du Tyrosol de l'Hydroxytyrosol, de l'Acide Caféique de l'Oleuropéine et de B.H.T. Rev. Fr. Corps Gras. 1988 , 8/9 , 339-344.
Chimi, H.; Cillard, J.; Cillard, P.; Rahmani, M. Peroxyl and Hydroxyl Radical Scavenging Activity of some Natural Phenolic Antioxidants. J. Am. Oil Chem. Soc. 1991 , 68 (5), 307-311.
Gennaro, L.; Bocca, A. P.; Modesti, D.; Masella, R.; Coni, E. Effect of Biophenols on Olive Oil Stability Evaluated by Thermogravimetric Analysis. J. Agric. Food Chem. 1998 , 46 (11), 4465-4469.
Haumann, B.F. Olive Oil. Mediterranean Product consumed Worldwide. INFORM . 1996 , 7 (9) , 890-903.
Limiroli, R.; Consonni, R.; Ranalli, A.; Bianchi, G.; Zetta, L. 1H NMR Study of Phenolics in the Vegetation Water of Three Cultivars of Olea europaea: Similarities and Differences. J. Agric. Food Chem. 1996 , 44 , 2040-2048.
Litridou, M.; Linssen, J.; Schols, H.; Bergmans, M.; Posthumus, M.; Tsimidou, M.; Boskou, D. Phenolic Compounds in Virgin Olive Oils: Fractionation by Solid Phase Extraction and Antioxidant Activity Assessment. J. Sci. Food. Agric. 1997 , 74 , 169-174.
Manzi, P.; Panfili, G.; Esti, M.; Pizzoferrato, L. Natural Antioxidants in the Unsaponifiable Fraction of Virgin Olive Oils From Different Cultivars. J. Sci. Food Agric. 1998 , 77 , 115-120.
Montedoro, G.; Servilli, M.; Baldioli, M.; Miniati, E. Simple and Hydroyzable Phenolic Compounds in Virgin Olive Oil. 1.Their Extraction, Separation, and Quantitative and Semiquantitative Evaluation by HPLC. J. Agric. Food Chem. 1992 , 40 , 1571-1576.
Montedoro, G.; Servilli, M.; Baldioli, M.; Miniati, E. Simple and Hydroyzable Phenolic Compounds in Virgin Olive Oil. 3. Spectroscopic Characterizations of the Secoiridoid Derivatives. J. Agric. Food Chem. 1993 , 41 , 2228-2234.
Papadopoulos, G.; Boskou, D. Antioxidant Effect of Natural Phenols on Olive Oil. J. Agric. Food Chem. 1991 , 68 (9) , 669-671.
Satue, M. T.; Huang, S.; Frankel, E. N. Effect of Natural Antioxidants in Virgin Olive Oil on Oxidative Stability of Refined, Bleached, and Deodorized Olive Oil. J. Am. Oil Chem. Soc. 1995 , 72 (10) , 1131-1137.
Tsimidou, M.; Papadopoulos, G.; Boskou, D. Phenolic Compounds and Stability of Virgin Olive Oil - Part I. Food Chemistry. 1992 , 45 , 141-144.
Zambiazi, R. C.; Przybylski, R. Effect of Endogenous Minor Components on the Oxidative Stability of Vegetable Oils. Lipid Technology. 1998 , 10 (3) , 58-62.
|

| |
|