|




Een initiatief van :
Stichting Food-Info

|

|
Food-Info.net> Onderwerpen > Literatuurverslagen
Winning en toepassingsmogelijkheden van wei-eiwitten
Door:
Bas van der Steen
Literatuuronderzoek
Wageningen Universiteit
Samenvatting
Een groot gedeelte van het melkeiwit bestaat uit wei-eiwitten. Deze eiwitten komen in opgeloste toestand in de melk voor; ze vormen de eiwitfractie in kaaswei. Wei is in het verleden altijd als het afval van de kaasindustrie beschouwd, het lozen van kaaswei veroorzaakte grote milieuproblemen. Doordat de eiwitten echter goede functionele eigenschappen hebben, is tegenwoordig de belangstelling voor de winning ervan groot.
Wei-eiwitten worden gezuiverd en zijn op de commerciële markt dan ook in verschillende zuiveringen verkrijgbaar. De raffinage van de wei gebeurt door middel van verschillende filtraties, chromatografie en ionenwisselaars. Van het mengsel van diverse hoogwaardig eiwitten wat na raffinage overblijft, is ß -lactoglobuline kwantitatief het belangrijkste bestanddeel. Afhankelijk van de hoeveelheid en het soort eiwit kunnen verschillende toepassingsmogelijkheden in levensmiddelen en non-food producten gevonden worden.
De verwachting is dat in de toekomst de mogelijkheden zullen toenemen, omdat tegenwoordig veel onderzoek gedaan wordt naar de functionele eigenschappen van de wei-eiwitten. Doordat de eiwitten zowel een nutritionele als een structurele bijdrage kunnen leveren aan allerhande eindproducten, zal tevens de variëteit aan toepassingen verbreed worden.
Inhoudsopgave
VOORWOORD 2
SAMENVATTING 3
1. INLEIDING 5
1.1. HISTORIE 5
1.2. WEI 5
2. WEI-EIWITTEN 7
2.1. VAN MELK NAAR WEI: 7
2.1.1. Kaaswei 7
2.1.2. Caseïnewei 7
2.2. DE TOEPASSINGEN VAN WEI 7
2.3. DE EIWITTEN IN DE WEI 7
3. WINNING VAN WEI-EIWITTEN 10
3.1. CONCENTRATIE VAN DE WEI 10
3.1.1. Indampen 10
3.1.2. Drogen 10
3.1.3. Demineralisatie 11
3.2. EIWITSPECIFIEKE WINNING 11
3.2.1. Membraanfiltratie 11
3.2.2. Chromatografie 13
3.2.3. Enzymatische behandeling 13
3.2.4. Overige behandelingen 13
4. TOEPASSINGSMOGELIJKHEDEN VAN WEI-EIWITTEN 14
4.1. STRUCTUUR EN FUNCTIONALITEIT VAN WEI-EIWITTEN 14
4.2. TOEPASSINGEN VAN WEI IN PRODUCTEN 14
4.2.1. Melkproducten 15
4.2.2. Snoep en dragees 15
4.2.3. Bakkerijproducten 16
4.2.4. Vlees- en visproductie 16
4.2.5. Voedingskundige en medicinale toepassingen 16
4.2.6. Dranken 16
4.3. EIWITSPECIFIEKE TOEPASSINGEN 16
4.4. WEI-EIWITTEN IN DE TOEKOMST 17
5. CONCLUSIES EN AANBEVELINGEN 18
6. LITERATUUR 19
1. Inleiding
1.1. Historie
Het maken van wei vond al ruim 3000 jaar voor Chr. plaats, toen Bedoeïenen hun melk in gedroogde dierenmagen meenamen op hun reizen door de woestijn. De hitte en een restant van de stremmende enzymen uit de maag zorgde ervoor dat de melk verzuurde en coalguleerde, wat een zure vloeistof (de wei) bovenop een soort wrongel opleverde [De Wit, 2001].
Wei is eigenlijk het 'afvalproduct' van de kaasmakerij. Het is de vloeistof, die uit de kaaswrongel druipt, dus grof gezegd melk zonder de caseïne en het vet [Daufin, et al . 2001]. Deze wei werd tot 10 à 15 jaar geleden voornamelijk als veevoer gebruikt. Er zitten echter nuttige melkeiwitten in de wei, die voor de mens belangrijke voedingsstoffen zijn. Daarom is de levensmiddelenindustrie geïnteresseerd geraakt in deze wei-eiwitten; bijvoorbeeld om ze te gebruiken voor het verdikken van sauzen [De Wit, 2001]. De wereldproductie van wei bedroeg in 1990 ongeveer 120 miljoen ton, waarvan 0,7 miljoen ton hoogwaardig eiwit, vergelijkbaar met het eiwitgehalte van 2 miljoen ton sojabonen [Bylund, 1995]. Tegenwoordig is dat zelfs toegenomen tot 150 miljoen ton, wat correspondeert met 9 miljoen ton droge stof [Daufin, et al . 2001]. Dus ondanks een chronisch eiwittekort in sommige delen van de wereld, wordt een substantieel deel van de totale weiproductie als afval beschouwd. In 1989-1990 bedroeg dit deel ongeveer 50% van de totale weiproductie [Bylund, 1995]. Dit hoge percentage maakt het interessant om te zoeken naar winnings- en toepassingsmogelijkheden voor dit product.
1.2. Wei
Wei vormt 80 tot 90% van het totale volume van melk wat het productieproces ingaat en het bevat ongeveer 50% van de nutriënten van de originele melk als eiwitten, lactose, vitaminen en mineralen. De wei die ontstaat als bijproduct bij de productie van harde, semi-harde en zachte kazen, wordt ook wel zoete wei genoemd en heeft een pH van 5,9-6,6 [Bylund, 1995]. Het proces om tot wei te komen is door de jaren heen geoptimaliseerd en tegenwoordig wordt ook wei gewonnen bij de productie van caseïne en caseïnepoeders [De Wit, 2001]. Maar de grootste hoeveelheden komen nog steeds uit reststromen van de kaasproductie. Tabel 1.1 geeft een overzicht van de bestanddelen van wei uit kaas- en caseïneproductie.
Tabel 1.1: De bestanddelen van verschillende soorten wei
Bestanddeel |
Kaaswei [%] |
Caseïnewei [%] |
Water |
93,6 |
93,5 |
Totaal drogestof |
6,4 |
6,5 |
Waarvan: |
|
|
Vet |
0,05 |
0,04 |
Eiwit |
0,55 |
0,55 |
NPN (niet eiwitgebonden stikstof) |
0,18 |
0,18 |
Lactose |
4,8 |
4,9 |
As (mineralen) |
0,5 |
0,8 |
Calcium |
0,043 |
0,12 |
Fosfor |
0,040 |
0,065 |
Natrium |
0,050 |
0,050 |
Kalium |
0,16 |
0,16 |
Chloride |
0,11 |
0,11 |
Melkzuur |
0,05 |
0,4 |
Tabel 1.1 laat zien dat de grootste verschillen tussen de kaaswei en de caseïnewei zich concentreren in het mineralen- en lactosegehalte. Wei is bekend om haar hoogwaardige bestanddelen. Zo wordt er lactose uit gewonnen voor de farmaceutische industrie en worden de eiwitten in de voedingsmiddelenindustrie verwerkt. Er is in het verleden ook al veel onderzoek gedaan naar eventuele toepassingen, zoals het onderzoek van Towler [1982] naar het toepassen van wei-eiwitten in pastadeeg. Hierbij werd de positieve invloed van wei-eiwitten op de visco-elastische eigenschappen beschreven. Ondanks de veelbelovende resultaten van deze nuttige ingrediënten, is het pas sinds de laatste jaren dat er commerciële processen ontwikkeld zijn om wei-eiwitproducten van een hoge kwaliteit te ontwikkelen.
De tijd dat wei gezien werd als afvalproduct is voorbij. Er is een groeiende belangstelling voor wei en weiproducten als functionele ingrediënten voor toepassingen in voeding, medicijnen en als nutriënten in dieet- en gezondheidsvoedsel. Tegenwoordig wordt meer dan 25% van de wei productie in de EU gebruikt voor menselijke consumptie, in de Verenigde Staten is dit zelfs al 50% [De Wit, 2001]. Nieuwe ontwikkelingen in de biochemie, microbiologie en andere technologische inzichten worden toegepast in de wei-industrie en dragen zorg voor een hoge kwaliteit en veilige producten. Tevens is de hoeveelheid informatie omtrent de compositie, winnings- en toepassingsmogelijkheden enorm toegenomen de laatste jaren.
2. Wei-eiwitten
2.1. Van melk naar wei:
2.1.1. Kaaswei
Bij de bereiding van kaas ontstaan reststromen van wei en room. Deze kunnen in andere productieprocessen hergebruikt worden. Tijdens twee stappen van het kaasmaken komt wei vrij. Allereerst tijdens het versnijden van wrongel, dit is ongeveer eenderde van de hoeveelheid wei. De rest van de wei verlaat het kaasproces tijdens het persen. Van deze beide wei-stromen wordt het laatste restje room gescheiden en terug in het proces gevoerd. Kaaswei is dus grofweg de vloeistof die overblijft nadat het vet en de caseïne uit de productstroom verwijderd zijn. Het is een vloeistof die, naast de vele nutriënten als eiwitten, lactose, vitamines en mineralen, ook enzymen, hormonen en andere groei-stimulerende middelen bevat. Naast hun nutritionele waarde hebben sommige wei-componenten een structuur opbouwende rol in producten [De Wit, 2001].
2.1.2. Caseïnewei
Ook door verzuring kan een vorm van wei ontstaan, al is dit vergeleken met de kaaswei een zeer kleine hoeveelheid. De productie van caseïne is eeuwenoud. Verzuring en coalgulatie van de melk veroorzaakte vroeger al het ontstaan van een zure vloeistof op een sediment van melkwrongel [De Wit, 2001]. Dit product wordt bereid door de melk te verzuren naar een pH van 4,6. Bij deze pH slaat caseïne neer. Zure wei bevat een hoog gehalte aan mineralen, in het bijzonder calciumfosfaat, en heeft vaak een bittere metaalachtige smaak. Verder heeft deze wei, omdat hij gemaakt wordt uit magere melk, vaak een laag vetgehalte [ www.protient.com ].
2.2. De toepassingen van wei
Wei, wat ook wel melkserum zonder de restjes caseïne genoemd wordt, heeft zeer veel toepassingen. Kaaswei wordt onder andere gebruikt in het onderzoek, bijvoorbeeld als groeimedium voor micro-organismen. Bij het kweken van recombinante strengen van Kluyveromyces marxianus creëert de vloeistof namelijk een prima klimaat voor de groei en productie van dit micro-organisme [Souza-Junior, et al ., 2001]. Hierin is de lactose uit de kaaswei een van de voedingsbronnen. Een ander doeleinde waarbij wei gebruikt kan worden is het biologisch afbreken van lignocellulose afval bij schimmels [Lewandowska en Bednarski, 1999]. Er verschijnen publicaties over toepassingen van wei in tijdschriften met betrekking tot voeding, farmacie, geneeskunde, procestechnologie en voedingsmiddelentechnologie [De Wit, 2001]. Dit geeft aan dat er vele, breed uiteenlopende toepassingen voor wei bekend zijn.
2.3. De eiwitten in de wei
Voor de voedingsmiddelenindustrie zijn vooral de eiwitten in de wei interessant. Hun functionele en nutritionele eigenschappen kunnen bijdragen aan de eindkwaliteit van het product. Slechts 0,55% van de wei bestaat uit eiwitten. Op drogestof basis is dit 8,5%. Wei bestaat daarnaast voor het overgrote deel uit lactose. De wei-eiwitten vormen een heterogeen mengsel, waarvan de voornaamsten ß -lactoglobuline, a -lactalbumine, bloedserumalbumine en immuunglobulinen zijn. Wei-eiwitten komen overwegend in moleculaire vorm voor, maar ook als zeer kleine aggregaten in melk. Ze worden vergezeld door tegenionen en enig water. De meeste wei-eiwitten zijn typisch globulaire eiwitten en bezitten een hoge hydrofobiciteit en een sterk opgevouwen peptideketen. Bij verhitting van de melk denatureren ze en worden onoplosbaar. De eiwitten vlokken echter niet uit, maar slaan neer op de caseïnemicellen en blijven in dispersie. Biest (kalvermelk) heeft een zeer hoog gehalte aan wei-eiwitten en stolt door verwarming als het wit van een ei. Dit gehalte, wat vaak tot wel 10% van de melk kan oplopen wordt verkregen door een hoog gehalte aan immuunglobulinen, dat als bescherming voor de kalveren dient [Wouters, 2001].
Structuur en fysische eigenschappen van de grote wei-eiwitfracties zijn meer bestudeerd dan welk ander eiwit in voedsel ook. Veel aandacht is hierbij besteed aan de relatie van de eiwitten met de functionele eigenschappen die ze kunnen hebben in voedsel. Deze eigenschappen hangen af van de omgeving waarin de eiwitten terechtkomen. Het gehalte aan vet, suikers en zouten is van belang, maar ook de procesmatige behandeling [De Wit, 2001]. Hieronder zullen allereerst de eiwitten afzonderlijk van elkaar met hun kenmerken worden beschreven.

Figuur 2.1: Schematische weergave van de tertiaire structuur van ß -lactoglobuline [Brownlow et al., 1997].
ß -Lactoglobuline vertegenwoordigt de grootste fractie binnen de wei-eiwitten. Het eiwit is erg hydrofoob en in zuiver water is het eiwit niet oplosbaar. De oplosbaarheid is sterk afhankelijk van de pH en de ionsterkte, maar het eiwit slaat niet neer bij aanzuren. Dit komt door de compacte vorm waarin het eiwit is opgevouwen (zie figuur 2.1). ß -Lactoglobuline bevat bijna geen proline en geen esterfosfaat. Verder heeft ze twee S-S bruggen en één vrije SH-groep, welke door zijn positie zeer reactief is. In melk komt het eiwit voor als een dimeer met een totaal molecuulgewicht van 36566. Beide moleculen zijn vrij hecht met elkaar verbonden, waarschijnlijk door de hydrofobe binding. Bij hoge temperatuur dissocieert het dimeer dan ook. Bij lage pH associeert ß -Lactoglobuline tot een octameer, waarschijnlijk niet door hydrofobe verbindingen. De genetische varianten dissociëren in verschillende mate [Wouters, 1999]. De biologische functie van ß -lactoglobuline is niet bekend. Het toepassen van de onbewerkte variant van dit eiwit in levensmiddelen kan leiden tot allergische reacties [Castro et al ., 1996].
a -Lactalbumine is als tweede grote fractie aanwezig in de wei. Het molecuul is sterk opgevouwen en vrijwel bolvormig, en is heel weinig pH- en zoutgevoelig. Het vertoont geen associatie, behalve bij zeer lage ionsterkte [Wouters, 1999]. a -Lactalbumine heeft in vergelijking met ß -lactoglobuline slechtere gelerings eigenschappen [Rantamaki, 2000]. Het molecuulgewicht is ongeveer 14400. Samen met ß -lactoglobuline zorgt dit eiwit tijdens denaturatie voor vrijwel alle eiwitfunctionaliteit [ www.protient.com ]. De biologische functie van a -lactalbumine is die van co-enzym bij de synthese van lactose. Het toepassen van de onbewerkte variant van dit eiwit in levensmiddelen kan leiden tot allergische reacties [Castro et al ., 1996]. Toch wordt dit eiwit gezien als het belangrijkste eiwit in moedermelk; dit om de nutritionele eigenschappen voor zuigelingen [De Wit, 2001].
Bloedserumalbumine is een langgerekt molecuul van ongeveer 3 bij 12 nanometer groot, dat vermoedelijk vanuit het bloedserum in de melk lekt. Het is een groot molecuul met veel –S-S- bruggen en heel veel a -helix structuur [Wouters, 1999]. Het eiwit bindt onoplosbare vetzuren, die tijdens de vertering van voedsel in de maag vrijkomen, om het te kunnen transporteren in het bloed [De Wit, 2001].
Immuunglobulinen zijn antilichamen, gevormd als afweer tegen specifieke antigenen. Ze komen vooral voor in bloed. Het zijn grote eiwitmoleculen van zeer heterogene samenstelling, zelfs binnen één sub-klasse. In melk komen de klassen G (gamma-), A (alfa-) en M (macro-globulinen) voor. Over de werking van IgA en IgM is niet veel bekend; sommige propionzuurbacteriën worden erdoor geremd. IgM is ook van ander belang, want het kan als antilichaam tegen polysaccharide-groepen optreden (welke voorkomen in de celwand van bacteriën) en is vooral actief tegen lichaamsvreemde stoffen als bacteriën en virussen. Deze deeltjes hebben reactieve plaatsen aan de buitenkant waarbij één IgM molecuul aan meerdere deeltjes hecht. Dit complex zal gaan uitvlokken. Deze uitvlokking wordt agglutinatie genoemd en het betreffende IgM heet agglutinine. De agglutinatiereactie is weer specifiek voor het antigeen, maar is tevens afhankelijk van factoren als pH en ionsterkte met een optimum tussen pH 5,5 en 7 en ionsterkte 0,05. Sommige agglutininen vertonen cryoprecipitatie en vlokken uit bij lage temperatuur (< 37ºC, maar zeker bij < 15ºC) en kunnen ook inerte deeltjes doen vlokken. Deze reactie is veelal niet specifiek maar gelijk aan agglutinatie. Deze agglutininen worden cryoglobulinen genoemd. IgM omvat tenminste één cryoglobuline. Dit speelt een rol bij de vlokking van melkvetbolletjes. Gevlokte melkvetbolletjes romen zeer snel op doordat er trosjes gevormd worden. Deze reactie is niet specifiek, want elk cryoglobuline vlokt vetbolletjes van alle soorten melk. Ook worden bacteriën aan deze vetbolletjes geagglutineerd. Deze reactie is waarschijnlijk wel specifiek, doordat bacteriën bij deze reacties uit het grootste deel van de melk verdwijnen. Bij gewone agglutinatie gebeurt dit naar de bodem van het vat, bij uitvlokking verdwijnen de bacteriën naar de roomlaag. Dit kan de groei en de werking van de bacteriën sterk remmen [Wouters, 1999].
Proteose-pepton bestaat overwegend uit een drietal verschillende splitsingsmoleculen van ß -caseïne (het complement van de ? -caseïnes) en komt daarom bij neutrale pH vooral in de caseïnemicellen voor. Kaaswei bevat hierdoor lang niet alle proteose-pepton, en de, via aanzuren verkregen, caseïnewei wel. Deze eiwitfractie wordt ook wel gedefinieerd als niet hittegevoelig, niet neerslaand bij pH 4,6 en wel neerslaand bij 12% trichloorazijnzuur en onderscheidt zich dus van de andere wei-eiwitten. Verder is het een eiwit wat verwant is aan een component van het vetbolletjesmembraan en vermoedelijk nog andere eiwitten die in sporen voor kunnen komen [Wouters, 1999].
Lysozym is chemisch verwant aan a -lactalbumine, al heeft de laatste geen anti-bacteriële werking. Het is een enzym wat (poly-)sacchariden van bacteriecelwanden hydrolyseert door het afsplitsen van muramidezuur, waardoor die bacteriën tenslotte oplossen (lyseren). De hoeveelheid in koemelk aanwezig lysozym is te gering om effectief te zijn (tot 2mg/l). Moedermelk bevat echter veel meer van dit enzym [Wouters, 1999].
Lactoferrine bindt ijzerionen in het serum en remt hierdoor onder meer Bacillus Stearothemophilus en Bacillus Subttilus . Het gebonden ijzer geeft het eiwit een rode kleur. Het gehalte van dit eiwit in koemelk is erg laag, moedermelk bevat meer lactoferrine [Wouters, 1999]. Consumptie van dit eiwit vergroot de biobeschikbaarheid van ijzer in de maag [De Wit, 2001].
Glycomacropeptide (GMP) is een hydrofiel peptide wat zorgt dat de micellaire structuur van caseïne in oplossing blijft. Als dit eiwit van het caseïne gescheiden wordt bij kaasbereiding, zorgt het ervoor dat caseïne onoplosbaar wordt. Verder heeft dit eiwit een stimulerende werking op de synthese van het hormoon cholecystokinine [ www.centuryfoods.com ]. GMP werd jarenlang niet tot de wei-eiwitten gerekend. Dit is te danken aan twee eigenschappen van het eiwit. Allereerst bevat GMP geen aromatische aminozuren, dus absorbeert het geen ultraviolet licht wat een makkelijke manier is om eiwitten te detecteren. Verder bindt het eiwit niet met de blauwe kleurstof die gebruikt wordt om de bandjes bij elektroforese te kleuren [ www.protient.com ].
Naast de genoemde eiwitten bevat wei, vaak als gevolg van enzymatische reacties, nog allerlei kleine peptidefragmenten.
Tabel 2.1 geeft de verhouding van de soorten wei-eiwitten in de wei weer.
Tabel 2.1: Verhoudingen wei-eiwitten in de wei [De Wit, 2001].
Wei-eiwit |
Percentage in wei |
ß-lactoglobuline |
50% |
a-lactalbumine |
20% |
bloedserumalbumine |
5% |
immuunglobulinen |
12% |
proteose-pepton |
10% |
lysozym |
0,42% |
lactoferrine |
0,75% |
glycomacropeptide |
2% |
Met de genoemde eiwitten en hun eigenschappen in het achterhoofd, zal gekeken worden naar de winning en toepassingsmogelijkheden van deze wei-eiwitten.
3. Winning van wei-eiwitten
3.1. Concentratie van de wei
De productie van weipoeder, gedemineraliseerd weipoeder, lactose en weipoeder zonder lactose overheerst momenteel de markt. Er vindt echter langzaam maar zeker een verschuiving plaats naar nieuwe en interessante producten welke het imago van wei als afvalproduct zullen veranderen die van een belangrijke grondstof voor de productie van kwaliteitsproducten [Bylund, 1995].
Wei moet zo snel mogelijk na de scheiding van de andere melkbestanddelen worden verwerkt, omdat de temperatuur en samenstelling van de wei bacteriegroei stimuleren. Is een snelle verwerking niet mogelijk, dan moet de wei tot 5ºC gekoeld worden om de groei tijdelijk af te remmen. Als het wettelijk toegestaan is, kan wei ook beschermd worden tegen bederf door het toevoegen van chemicaliën als bijvoorbeeld natriumdisulfaat [Bylund, 1995].
3.1.1. Indampen
Wei wordt om verschillende redenen geconcentreerd en gedroogd. Allereerst wordt het water verwijderd om de kosten voor opslag te kunnen drukken. Verder induceert het indampen, door de slechte oplosbaarheid van lactose in wei-concentraat, de kristallisatie van lactose [De Wit, 2001]. Om het drogestofgehalte van wei te kunnen verhogen naar 50-60% is veel energie nodig. Daarom wordt vaak gebruik gemaakt van een verdamping in meerdere stappen. Een voorbeeld van een dergelijke installatie is een vallende film verdamper, waarbij de wei als een dunne film door enkele buisjes stroomt. Deze buizen worden verhit door stoom. Hoe meer verdampers er in serie geschakeld kunnen worden, hoe economischer er omgegaan kan worden met de stoom. De damp van de ene verdamper kan als verhittingsbron van de volgende dienen. Een cycloon zorgt uiteindelijk voor een goede scheiding tussen verdampt water en het wei-concentraat. [De Wit, 2001].
Er wordt een verschil gemaakt tussen concentraten die zogenaamd low-heat en high-heat zijn. De low-heat concentraten zijn op de normale wijze gefabriceerd. Bij de high-heat weipoeders is echter een hogere temperatuur aangehouden of is de productstroom langer in het systeem aanwezig geweest. Dit resulteert in andere functionele eigenschappen. High-heat poeders kunnen door deze eigenschappen bijvoorbeeld toegepast worden als hulpmiddel bij het bakken van brood. Deze kwalitatief betere poeders zijn echter wel duurder [De Wit, 2001].
3.1.2. Drogen
Het drogen van wei kan gezien worden als een vervolg op het verdampen met als doel het produceren van een stabiel product met een laag vochtgehalte. De meeste poeders worden gedroogd met een sproeidrooginstallatie. Voor speciale doelen wordt gebruik gemaakt van walsdrogers. Deze laatste drogers worden vaak gebruikt voor het drogen van melk en eiwitrijke producten die een intensieve hittebehandeling nodig hebben. Zo kunnen er specifieke producten als melkpoeders, caseïnaten en enkele weiproducten mee gedroogd worden. 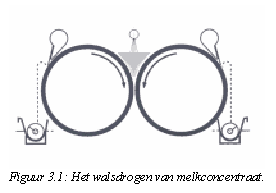 Een walsdroger bestaat uit twee metalen cilinders met een diameter van ongeveer één meter die van binnenuit verhit worden tot ongeveer 100°C. De cilinders draaien in tegengestelde richting en het concentraat wordt op de cilinders gesproeid (zie figuur 3.1). Deze techniek is de goedkoopste manier om concentraten verder te drogen, maar kan door de hoge temperatuur ongewenste schade aan de eiwitten aanrichten wat een verlies aan functionele eigenschappen tot gevolg kan hebben [Bylund, 1995]. Een walsdroger bestaat uit twee metalen cilinders met een diameter van ongeveer één meter die van binnenuit verhit worden tot ongeveer 100°C. De cilinders draaien in tegengestelde richting en het concentraat wordt op de cilinders gesproeid (zie figuur 3.1). Deze techniek is de goedkoopste manier om concentraten verder te drogen, maar kan door de hoge temperatuur ongewenste schade aan de eiwitten aanrichten wat een verlies aan functionele eigenschappen tot gevolg kan hebben [Bylund, 1995].
Bij sproeidrogen wordt het concentraat met droge lucht van 225°C in een droogkamer gesproeid. Doordat de stroom in een kamer van 65°C terechtkomt, verdampt het water uit de druppels. Het product wordt hierbij nooit warmer dan 65-75°C. De stroom kan door zogenaamde ‘nozzle' verstuifd worden of door een roterend wiel verdeeld worden. De lucht die de kamer verlaat bevat nog kleine deeltjes die met behulp van een cycloon worden teruggevoerd in het proces [Bylund, 1995].
Het afkoelen en verpakken van de poeders in luchtdichte zakken zorgt voor goede bewaareigenschappen. Ook zal het vroegtijdig uitkristalliseren van lactose voorkomen dat het poeder plakkerig wordt [De Wit, 2001].
3.1.3. Demineralisatie
Het verwijderen van mineralen en een aantal organische zuren kan plaatsvinden door ionenwisseling of elektrodialyse. De verschillende zouten in wei hebben namelijk een belangrijke invloed op de smaak. Dit kan de toepasbaarheid van de eiwitten in de weg staan. In wei, waar de lactose uitgehaald is, zal het mineralengehalte gestegen zijn naar 20% van de drogestof.
Door gebruik te maken van een ionenwisselaar kan dit gehalte verminderd worden. De wei stroomt dan door een sterke kationwisselaar waar de kationen die in de wei zitten verwisselt worden met H+ ionen uit de wisselaar. Hierbij wordt de pH verlaagd naar 1,5. Vervolgens wordt de pH weer verhoogd door de wei door een anionwisselaar te laten stromen waar de, in de wei aanwezige, anionen uitgewisseld worden met OH- ionen uit de kolom. De kolommen worden na gebruik weer hersteld door er HCL (voor de kationwisselaar) en NaOH (voor de anionwisselaar) doorheen te laten stromen. Deze techniek kan de wei voor 90% demineraliseren, maar is duur en produceert veel afval [De Wit, 2001].
Elektrodialyse is een sneller en goedkoper proces om wei te demineraliseren. Een elektrodialyse-opstelling bestaat uit verschillende ruimtes, gescheiden door kation- en anionmembranen. De negatief geladen ionen gaan door een positief geladen anionmembraan, maar worden gestopt door het negatief geladen kationmembraan. Voor de positief geladen ionen geldt het omgekeerde. Deze methode heeft als nadeel dat er in wei een aantal dubbel geladen ionen voorkomen (Ca ++ en Mg++) die gebonden zijn aan negatief geladen eiwitten of aan fosfaationen. Deze worden maar gedeeltelijk verwijderd. Er kan dus gesteld worden dat het gebruik van elektrodialyse wei oplevert met een hoger calcium-, magnesium- en fosforgehalte, dan wei die gedemineraliseerd is door een ionenwisselaar [De Wit, 2001].
3.2. Eiwitspecifieke winning
De complexe samenstelling van de eiwitten in wei-eiwitconcentraten heeft een limiterend effect op de functionele eigenschappen en dus op de mogelijke toepassingen van de concentraten [Pearce, 1991]. Het is derhalve interessant om de mogelijkheden van het concentreren van de afzonderlijke eiwitten te bekijken. Deze stappen vinden in de regel plaats voor de uiteindelijke droogstap van §3.1.2.
3.2.1. Membraanfiltratie
Het gebruik van membranen in de procestechnologie heeft de laatste 25 jaar een enorme vlucht genomen. De voedingsmiddelenindustrie bestrijkt inmiddels 20-30% van de gehele membranenmarkt. De hoofdmoot (40%) daarvan komt voor rekening van de zuivelindustrie, waarbij de membranen vooral gebruikt worden voor de standaardisatie van melk [Daufin, et al ., 2001]. Zo scheppen de ontwikkelingen in membraanfiltratietechnieken de mogelijkheid om een grote variëteit aan verschillende wei-concentraten en –isolaten commercieel te produceren. Membraanprocessen worden ingezet om ingrediënten te kunnen scheiden op hun verschil in molecuulgrootte [Rantamaki et al ., 2000]. Deze scheiding omvat meerdere niveaus. Zo wordt microfiltratie (MF) gebruikt om vetbolletjes en bacteriën te kunnen scheiden en ultrafiltratie (UF) voor het scheiden van eiwitten. Daarnaast wordt nanofiltratie (NF) toegepast om de vloeistof te ontdoen van zouten en omgekeerde osmose (RO) kan het water afscheiden [De Wit, 2001]. Voor dit onderzoek is vooral de techniek van de ultrafiltratie interessant, omdat die van belang is voor de eiwitten. Deze zal dan ook nader worden beschreven.
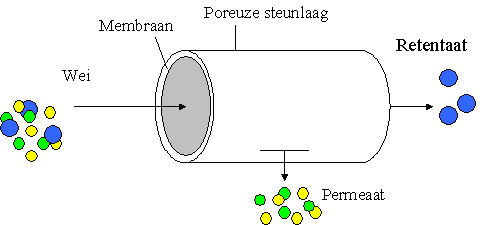
Figuur 3.1: Schematisch overzicht van het ultrafiltreren van wei [De Wit, 2001].
Met ultrafiltratie is het mogelijk om moleculen van 0,001-0,4 µ m uit de wei te filtreren. Dit betekent dat de vitaminen, wei-eiwitten, caseïnemicellen en een gedeelte van de wei-eiwitaggragaten met deze techniek geïsoleerd kunnen worden [Bylund, 1995]. Er zijn verschillende manieren om te filtreren. Bij een buisvormig ontwerp van de filtratieopstelling (zie figuur 3.1) kan tevens geselecteerd worden op molecuulgewicht. Fracties kleiner dan 10.000 Dalton zullen door het membraan gaan. Dit permeaat bevat dan het aanwezige lactose, mineralen en water. De fractie die niet door het membraan komt bevat de restanten vet en het eiwit, en wordt het retentaat genoemd. De limiet voor wei-eiwitconcentratie ligt in de praktijk op 20 keer concentreren, wat een volumereductie van 95% betekent. Bij een hogere reductie wordt het retentaat te viskeus en kan het niet zonder uitspoelen van het membraan verwijderd worden [De Wit, 2001].
Industrieel geproduceerde wei-eiwitconcentraten (WEC) worden verdeeld in de categorieën laag-eiwit WEC (eiwitgehalte tussen 25-40%), medium-eiwit WEC (eiwitgehalte tussen 45-60%) en hoog-eiwit WEC (eiwitgehalte tussen 60-80%).
Wei-eiwitisolaten zijn hierbij nog een aparte categorie met een eiwitgehalte van 90%. Ze worden geproduceerd door het gebruik van een ionenwisselaar gevolgd door een concentratiestap of door microfiltratie gevolgd door ultrafiltratie. Deze twee productiemethoden leveren echter niet exact hetzelfde isolaat op. Bij de ionenwisseling worden namelijk sommige eiwitfracties niet geheel uitgespoeld, wat vooral een veel kleinere hoeveelheid GMP oplevert [ www.centuryfoods.com ].
Om een overzicht te creëren tussen de verschillende gradaties in concentreren, wordt in tabel 3.1 de samenstelling van de besproken producten gegeven. Het getal achter WEC staat voor het percentage eiwit wat erin zit. Opvallend is dat het vetgehalte toeneemt met de mate van concentreren en dat het gehalte aan lactose en mineralen afneemt. De laatste groep verdwijnt met het permeaat [De Wit, 2001].
Tabel 3.1: Samenstelling van wei-poeders, permeaat, retentaat en isolaat [De Wit, 2001] [ www.centuryfoods.com ].
Component |
Permeaat : |
WEC-35 |
WEC-60 |
WEC-80 |
WI |
Totaal eiwit |
3,3% |
36,2% |
63,0% |
81,0% |
92,0% |
Eiwit |
0% |
29,7% |
59,4% |
75,0% |
: |
Niet-eiwitgebonden stikstof |
3,3% |
6,5% |
3,6% |
6,0% |
: |
Lactose |
81,3% |
46,5% |
21,1% |
3,5% |
: |
Mineralen (as) |
8,2% |
7,8% |
3,9% |
3,1% |
3,0% |
Vetten |
0% |
2,1% |
5,6% |
7,2% |
1,0% |
Melkzuur |
3,2% |
2,8% |
2,2% |
1,2% |
: |
Water |
4,0% |
4,6% |
4,2% |
4,0% |
4,0% |
De samenstelling van WEC-35 komt overeen met mager melkpoeder, of met gedemineraliseerde wei zonder lactose. WEC-60 is het meest optimale product wat verkregen kan worden met ultrafiltratie. WEC-80 is het product van een diafiltratiebehandeling van geültrafiltreerde wei [De Wit, 2001].
3.2.2. Chromatografie
De concentraten die met indampen verkregen zijn, bestaan nog steeds niet uit 100% eiwit. Verschillende technieken op basis van chromatografie maken het mogelijk om het eiwit van de rest te scheiden. Zo is gelfiltratiechromotografie gebaseerd op het verschil in molecuulgrootte tussen eiwitten en andere ingrediënten. Het scheidingsprincipe berust op het verschil in diffusiesnelheid van de deeltjes door een kolom. Deze kolom is gevuld met poreuze balletjes. De kleinere deeltjes als zouten, lactose en niet-eiwitgebonden stikstof zullen langer in de kolom blijven hangen, omdat ze in de poriën van de balletjes blijven hangen. De eiwitten lopen dus sneller door de kolom heen. Deze techniek wordt meestal gebruikt als laatste zuiveringsstap [De Wit, 2001]. Ongeveer hetzelfde effect kan verkregen worden door de wei door een kolom te laten lopen waarbij de eiwitten van een bepaalde lading hun ‘tegenpolen' in de kolom gaan opzoeken en de andere ingrediënten door de kolom heen lopen. Deze scheidingstechniek wordt ionenwisselchromatografie genoemd. Belangrijke parameters hierbij zijn de pH van de wei, de netto lading van het eiwit en de bindingcapaciteit van de kolom. Een derde techniek is de affiniteitchromatografie die gebruikmaakt van een scheidingsmethode op basis van bepaalde molecuul-molecuul interacties [De Wit, 2001].
3.2.3. Enzymatische behandeling
Het enzymatisch hydrolyseren van zure wei voor het gebruik in voedingsmiddelen kan de allergische werking van verschillende wei-eiwitten verminderen. Enzymen, geproduceerd door Bacillus subtilus , kunnen zo bijvoorbeeld a –lactalbumine en ß –lactoglobuline door hydrolyse beter toepasbaar maken voor verwerking. Hierbij dient voorkomen te worden dat er bittere peptides geproduceerd worden [Castro et al ., 1996].
3.2.4. Overige behandelingen
Naast de relatief grote fracties van lactose en eiwitten is het mogelijk nog specifieker op ingrediënten te isoleren. Hierbij kan gedacht worden aan de isolatie van specifieke wei-eiwitten. Zo zijn bijvoorbeeld a -lactoglobuline, ß -lactalbumine, lactoferrine en lactoperoxidase te scheiden op basis van hun lading, relatieve hydrofobiciteit en molecuulgewicht of –grootte. Hiervoor zijn, op basis van deze unieke eigenschappen van het eiwit, aparte technieken ontwikkeld. Methoden die gebruik maken van de specifieke lading van een eiwit, zoals de eerder genoemde ionenwisselchromatografie. Lactoferrine en lactoperoxidase worden met deze methode op industriële schaal gescheiden [ www.dmv-international.com ]. Een andere behandeling is het concentreren van bijvoorbeeld a –lactalbumine bij een zure pH door hitte-aggregatie [Rantamaki et al ., 2000].
Natuurlijk is het ook mogelijk om de andere interessante componenten in de wei te concentreren. Zo worden lactose en de in wei aanwezige zouten al op industriële schaal uit de wei gewonnen [De Wit, 2001].
4. Toepassingsmogelijkheden van wei-eiwitten
4.1. Structuur en functionaliteit van wei-eiwitten
Voordat de toepassingen van wei aan bod komen zal eerst wat achtergrondinformatie over de structuur en functionaliteit van de wei-eiwitten gegeven worden. De wei-eiwitten, zoals die door de koe aan de melk worden afgegeven, staan voor een aantal functionele eigenschappen. Deze eigenschappen worden gedurende de productieketen bewust aangepast om uiteindelijk de gewenste eigenschappen te behouden. Soms worden ze echter ook ongewenst beïnvloed. Intrinsieke eigenschappen van de wei-eiwitten die een rol spelen bij die uiteindelijke eigenschappen zijn de aminozuurvolgorde, de eiwitconformatie, nettolading en de mate van hydrofobiciteit. Daarbij komen een aantal extrinsieke factoren als de temperatuur, de pH en de aanwezigheid van zouten. Hierdoor worden de functionele eigenschappen van het wei-eiwit bepaald. Of deze eigenschappen ook daadwerkelijk tot hun recht komen, hangt af van de andere componenten die aanwezig zijn in het product als vetten, suikers en andere eiwitten. Verder spelen de uitgevoerde processen als homogeniseren, verhitten en opslag een grote rol in de uiteindelijke eiwitfunctionaliteit. Tot de functionele eigenschappen van wei-eiwitten behoren oploseigenschappen, emulgeren, schuimen en opkloppen, geleren, waterabsorptie en het geven van geur en kleur aan het product [De Wit, 2001]. Deze functionele eigenschappen worden in tabel 4.1 weergegeven. Hierbij wordt ook al vooruitgekeken naar de producten waarin ze toegepast kunnen worden.
Tabel 4.1: Functionele eigenschappen van wei-eiwitten in producten [De Wit, 2001].
Functionele eigenschap |
Eigenschap in product |
Product |
Oplosbaarheid |
Oplossen in product |
Dranken |
Absorptie van water |
Water binden |
Vlees- en bakkerijproducten |
Viscositeit |
Verdikken |
Soupen en sauzen |
Geleren |
Structuur geven |
Vlees en visproducten |
Emulgeren |
Oplossen, emulgeren |
Poedermelk |
Absorptie van vet |
Vrij vet binden |
Worst |
Schuimen |
Lucht inslaan |
Slagroom, toppings |
Smaak binden |
Smaak binden en loslaten |
Flesvoeding |
Zouten binden |
Specifieke absorptie |
Nutritionele voedingsmiddelen |
4.2. Toepassingen van wei in producten
In het verleden is wei vaak gezien als remedie tegen allerlei ziektes en werd het bijvoorbeeld in thermaalbaden en kuuroorden gebruikt. De ongebalanceerde compositie van wei in vaste vorm zorgde echter voor gelimiteerde toepassingen in voedingsmiddelen. Vooral de aanwezigheid van lactose (72%) en mineralen (8%) gaven daarbij problemen. De stijgende productie van wei en weipoeder stimuleerde het gebruik als supplement in diervoeding, vooral als goedkope vervanger van magere melkpoeder. Zowel in vloeibare als in poedervorm werd deze hoogwaardige eiwitbron verwerkt tot voeder [Sienkewicz en Riedel, 1990]. Door de introductie van scheidings- en isolatietechnieken voor weicomponenten (zie hoofdstuk 3) worden wei-eiwitconcentraten in voedingsmiddelen gebruikt als verstevigingsmiddel en vervanger van functionele ingrediënten. Toepassingen worden gevonden in bakkerijproducten, zuivel, ijs, verwerkt vlees, dieetproducten en dranken [King, 1996]. Figuur 4.1 geeft een groot aantal toepassingen van wei in food- en non-foodproducten weer. Deze zullen nader besproken worden. Ook is in de figuur weergegeven welke behandeling de wei moet ondergaan om de toepassing in het product mogelijk te maken.
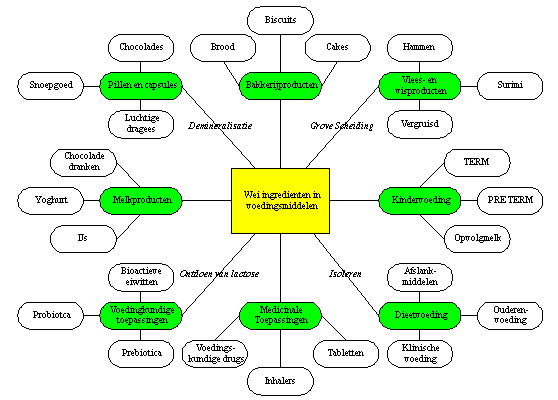
Figuur 4.1: Overzicht toepassingen wei en wei-eiwitten in producten [De Wit, 2001]
Afhankelijk van de productgroep en de kosten die de raffinage van de wei met zich meebrengt, worden toepassingen gevonden. Zo zal in sommige gevallen lactose nog aanwezig zijn in het wei-eiwitconcentraat. Het is zelfs mogelijk dat lactose een rol van betekenis speelt in de toepassing van wei in het product.
4.2.1. Melkproducten
Nadat de wei als reststroom uit de zuivelketen is ontstaan, is deze na raffinage eventueel weer terug te voeren in deze keten. Voorbeelden hiervan zijn het gebruik van wei-eiwitconcentraten om een gewenst eiwitgehalte te krijgen bij de productie van ijs en yoghurt. Vaak dienen die concentraten als vervanging van het duurdere magere melkpoeder. Bij yoghurt heeft het echter ook een structuur opbouwende werking. In magere melkpoeder zit namelijk meer caseïne als eiwitbron en dit poeder staat bekend om zijn mindere capaciteiten als het gaat om het verlenen van structuur aan het eindproduct [De Wit, 2001]. De wei-eiwitten dragen op deze manier bij aan de structuur en stabiliteit van het eindproduct.
Bij relatief vettere melkproducten als chocolademelk, maar ook chocoladerepen met een vulling op melkbasis, zorgt het toevoegen van wei-eiwitten voor een betere colloïdale stabiliteit. De eiwitten zorgen ervoor dat de vetbolletjes minder snel opromen of homogeen over het product verdeeld blijven, doordat een zwak netwerk gevormd wordt. Ook bij toppings en slagroom kunnen wei-eiwitten gebruikt worden. Hier zorgen zij voor een beter opklopvermogen. In dit geval worden echter luchtbelletjes ingeslagen [De Wit en Hontelez-Backx, 1983]. De verschillende eiwitconcentraten vertonen hierbij een verschil in kwaliteit. Zo kan het WEC-60 de opklopcapaciteit van ei-eiwit benaderen [De Wit, 2001]. Maar ook zal het gebruik van wei-eiwitten in soepen en sauzen, door de hitte tijdens het proces, een verdikkende en stabiliserende werking hebben [De Wit, 2001].
4.2.2. Snoep en dragees
In snoepproducten en luchtige dragees kan wei toegepast worden om kleur en smaak aan het product te geven. De werkzame stof uit de wei is in dit geval de lactose die door middel van de Maillard reactie het eindproduct van zijn karakteristieke eigenschappen kan voorzien. De wei-eiwitten kunnen bij deze reactie een belangrijke rol spelen doordat tijdens verhitten tussen lactose en de eiwitten een interactie optreedt. De gegenereerde smaak en de bruine kleur is dus mede te danken aan de wei-eiwitten [De Wit, 2001].
4.2.3. Bakkerijproducten
Kaaswei is al sinds jaar en dag een bekend ingrediënt in de bakkerijsector. Het volume, de textuur, korst en het behoud van versheid in brood worden allemaal geoptimaliseerd door het toevoegen van emulgeermiddelen en weipoeder [Jacobsen, 1997]. Ook is bekend dat de interactie tussen wei-eiwitten en eiwitten uit tarwe de deegvorming en de kleur en structuur van het eindproduct verbeteren [De Wit, 2001][De Wit en Hontelez-Backx, 1983]. Bij de productie van cakes, waar vetten ook een belangrijk ingrediënt zijn, dienen wei-eiwitten voor de vetbinding en hittecoalgulatie te zorgen[De Wit en Hontelez-Backx, 1983].
Tevens worden wei-eiwitten om de nutritionele eigenschappen in bakkerijproducten toegepast. Zo draagt het gebruik van weipoeder bij de bereiding van biscuitjes bij aan een hogere eiwitkwaliteit door de aanwezigheid van meer essentiële aminozuren [De Wit, 2001].
4.2.4. Vlees- en visproductie
De wei-eiwitten die gebruikt worden bij de productie van hammen dienen goed oplosbaar te zijn en een lage viscositeit te hebben. Alleen dan kunnen ze de gewenste structuur van het eindproduct garanderen [De Wit en Hontelez-Backx, 1983]. Ook bij vergruisd vlees vinden wei-eiwitten hun toepassing. Hierbij kan gedacht worden aan knakworsten en Frankfurters. De gebruikte wei-eiwitten zorgen hier voor vet- en waterbinding [De Wit en Hontelez-Backx, 1983]. De wei-eiwitten hebben door de verhittingsstap in het productieproces tevens een gelerende werking, wat de structuur van het eindproduct ten goede komt. Om dezelfde redenen wordt dan ook bij vergruisde vis (bijvoorbeeld surimi) gebruik gemaakt van wei-eiwit [De Wit, 2001]. Maar ook in geëxtrudeerde producten, als sommige Japanse vissoorten, kunnen wei-eiwitten voor de gewenste textuur zorgen [ www.biziworks.com.au ].
4.2.5. Voedingskundige en medicinale toepassingen
Naast de hittestabiliserende en emulgerende werking van de eiwitten wordt ook om nutritionele redenen gebruik gemaakt van wei-eiwitten. De eiwitkwaliteit van wei-eiwitten ligt vele malen hoger dan die van caseine, wat een optimalere groei kan bevorderen [ www.protient.com ]. Allerlei soorten flesvoeding en opvolgmelk maken gebruik van deze bron van essentiële aminozuren. Maar ook aan afslankmiddelen, diëten voor ouderen en klinische voeding worden wei-eiwitten toegevoegd [De Wit, 2001]. Er worden zelfs wei-eiwit-bevattende preparaten voorgeschreven om de aminozuren die ze bevatten. Deze eiwitten kunnen ingenomen worden als aanvulling op het dagelijkse dieet [ www.wheyoflife.org ]. Tevens worden wei-eiwitten als krachtbron voor bodybuilding aangewend. Een zoektocht op internet leert al gauw dat aanbieders elkaar verdringen om deze energieverhogende poly-peptiden aan de man te brengen. Het gebruik van wei-eiwitten zorgt ervoor dat het lichaam vet efficiënter verbrand en dat de spiermassa toeneemt [ www.bodybuilding.com ][ www.issresearch.com ]. Tot slot dient de toepassing van wei om ziekten te behandelen en als groei factor bij weefselkweek genoemd te worden [ www.biziworks.com.au ].
4.2.6. Dranken
Enkele frisdrankfabrikanten maken ook gebruik van wei-eiwitten om deze te verwerken in hun product. Naast het verhogen van de hoeveelheid eiwitten, zullen de eiwitten in deze producten ook bijdragen aan de stabiliteit [De Wit, 2001].
4.3. Eiwitspecifieke toepassingen
Doordat wei-eiwitten verschillende eigenschappen hebben en ook specifiek op soort geconcentreerd kunnen worden, is het interessant te kijken welke toepassingen er zijn voor deze hoogwaardige concentraten [Rantamaki et al ., 2000]. In hoofdstuk 2 zijn, bij de bespreking van de verschillende eiwitcomponenten al voorbeelden hiervan aangehaald. Van de kleinere eiwitcomponenten van de wei voorkomt lysozym bijvoorbeeld het te laat vormen van gas gedurende het rijpen van kaas en het ontstaan van een off-flavour [De Wit, 2001]. Lactoferrine wordt als voedingssupplement gebruikt om de biobeschikbaarheid van ijzer te verhogen [ www.dmv-international.com ].
4.4. Wei-eiwitten in de toekomst
Het gebruik van wei-eiwitten in food- en non-foodproducten heeft de afgelopen jaren een enorme opmars meegemaakt. De functionele eigenschappen van de eiwitten maken zeer diverse toepassingen mogelijk. De productie van wei-eiwitten op steeds grotere schaal, getuige ook de opening van een grote wei-eiwitfabriek in Argentinië [ www.arlafoods.com ], maakt het gebruik van deze eiwitbron steeds beter betaalbaar.
5. Conclusies en aanbevelingen
Het is duidelijk dat door een groeiende interesse wei-eiwitten niet meer alleen beschouwd worden als een afvalproduct van de zuivelindustrie. De vele toepassingen in uiteenlopende producten, zowel in de food- als in de non-food sector hebben de vraag naar wei en wei-afgeleiden sterk doen toenemen.
Daarnaast is de winning en het zuiveren van speciale functionele elementen uit de wei door veel onderzoek sterk verbeterd, zodat ook op industriële schaal voor een redelijke prijs weiproducten geproduceerd kunnen worden.
De verwachting is dat in de toekomst het aantal mogelijkheden verder zal stijgen, omdat nog steeds veel onderzoek gedaan wordt naar de functionele eigenschappen van de wei-eiwitten. Doordat de eiwitten zowel een nutritionele als een structurele bijdrage kunnen leveren aan allerhande eindproducten, zal de variëteit aan toepassingen nog stijgen.
6. Literatuur
Boeken en artikelen:
- Brownlow, S., J.H.M. Cabra, R. Cooper, D.R. Flower, S.J. Yewdall, I. Polikarpov, A.C.T. North, L. Sawyer, Bovine ß-lactoglobulin at 1.8 A resolution: still an enigmatic lipocalin, Structure, 1997, Vol. 5, blz. 481-495.
- Bylund, G., Dairy processing handbook, Tetra Pak Processing Systems AB, Lund, Zweden, 1995.
- Castro, S., C.V. Peyronel, A.M.B. Cantera, Proteolysis of whey proteins by a Bacillus subtilus enzyme preparation, International Dairy Journal, 1996, Vol. 6 (3), blz. 285-294.
- Daufin, G., J.P. Escudier, H. Carriere, S. Berot, L. Fillaudeau, M, Decloux, Recent and emerging applications of membrane processes in the food and dairy industry, Trans IchemE, 2001, Vol. 79, blz. 89-102.
- Jacobsen, K.A., Whey protein concentrates as functional ingredients in baked goods, Cereal Food World, 1997, Vol. 42 (3), blz. 138-141.
- King, L., Whey protein concentrates as ingredients, Food Tech Europe, 1996, Vol. 3 (1), blz. 88-89.
- Lewandowska, M., W. Bednarski, Utilisation of whey for bio-converting agricultural lignocellulosic wastes by fungi, Natural Sciences, 1999, Vol. 3, 153-166.
- Mann, E., Whey utilisation part 1, Dairy Industries International, 1997, Vol. 62 (3), blz. 17-18.
- Pearce, R.J., Applications for cheese whey protein fractions, CSIRO Food Research Quarterly, 1991, Vol. 51 (1/2), blz. 74-85.
- Rantamaki, P., O. Tossavainen, M. Outinen, T. Tupasela, P. Koskela, M. Kaunismake, Functional properties of the whey protein fractions produced in pilot scale processes. Foaming, water-holding capacity and gelation, Milchwissenschaft, 2000, Vol. 55 (10), blz. 569-572.
- Sienkiewicz, T., C.L., Riedel, Whey and whey utilization: Possibilities for utilization in agriculture and foodstuffs production, Verlag Th. Mann, Duitsland, 1990.
- Souza-Junior C.G. de, W.M. Ledingham, M.A. de Morais-Junior, Utilisation of cheese whey as an alternative growth medium for recombinant strains of Kluyveromyces marxianus, Biotechnology-Letters, 2001, Vol. 23 (17), blz. 1413-1416.
- Towler, C., Utilisation of whey protein products in pasta, New Zealand Journal of Dairy Science and Technology, 1982, Vol. 17 (3), blz. 229-236.
- Wit, J.N. de, E. Hontelez-Backx, Functional properties of whey protein products in food products, Voedingsmiddelentechnologie, 1984, Vol. 17 (2), blz. 19-23.
- Wit, J.N. de, Lecturer's Handbook on whey and whey products, European Whey Products Association, Brussels, 2001.
- Wouters, Prof. Dr. J.T.M., Melkkunde, een inleiding in samenstelling, structuur en eigenschappen van melk, Leerstoelgroep Geïntegreerde Levensmiddelentechnologie, Wageningen Universiteit, Wageningen, 1999.
- Wouters, Prof. Dr. J.T.M., Zuiveltechnologie, Leerstoelgroep Productontwerpen en Kwaliteitskunde, Wageningen Universiteit, Wageningen, 2001.
Internetpagina's:
|

| |
|




