Food-Info.net> Onderwerpen > Literatuurverslagen
Bioactieve Peptiden als Eetlustremmers
Wageningen Universiteit
Wageningen, april 2002
Karin Struijs
Samenvatting
De afgelopen jaren is de bevolking van de westerse wereld te veel gaan eten. Hierdoor kregen er steeds meer mensen die te maken met overgewicht. Als oplossing voor dit probleem zijn de afgelopen jaren veel ‘light'-producten op de markt gekomen. Die moeten ervoor zorgen dat de energie-inname verminderd wordt en dat mensen minder gaan eten. In dit literatuuronderzoek wordt gekeken naar bioactieve peptiden die de eetlust kunnen remmen en zo ervoor zorgen dat mensen minder gaan eten. Somatostatine, Cholecytokinine, Gastrine, Thyrotropine Releasing hormoon en Leptine zijn hormonen die een rol spelen bij de eetlustregulatie maar de werking van deze hormonen wordt niet door voedselbestanddelen beïnvloed.
Serotonine wordt uit tryptofaan gevormd via de serotonine-route. Deze omzetting vindt plaats in de hersenen, daarom moet tryptofaan in de hersenen terechtkomen. Als de verhouding tryptofaan en grote neutrale aminozuren hoog is, kan tryptofaan makkelijk de bloed-hersenbarrière passeren en in de hersenen omgezet worden. Serotonine is een belangrijke neurotransmitter in de voedselregulatie. Het heeft invloed op het verzadigingsgevoel doordat serotonine het regelmatigheidspatroon reguleert. Op de lange termijn zorgt serotonine ervoor dat de voedselinname vermindert en dat daardoor een gewichtsverlies optreedt.
Het gehalte tryptofaan in het lichaam kan verhoogd worden door tryptofaan rijke producten te eten en te zorgen dat het gehalte aan grote neutrale aminozuren relatief laag blijft. Bij de bereiding en verwerking van tryptofaan rijke producten rekening moet rekening gehouden worden met optreden van maillard-reacties. Serotonine zelf komt maar in een paar producten voor.
Opioid peptiden kunnen ingedeeld worden in opioid agonisten en opioid antagonisten. Opioid agonisten grijpen aan op 3 typen receptoren die elk hun eigen effect geven. Ze hebben onder andere effect op de darmbewegingen en op de afgifte van insuline waardoor de voedselopname vermindert en het lichaamsgewicht afneemt. Opioid agonisten worden veelal uit caseïnes gevormd. Dit gebeurt onder normale omstandigheden ook. Buiten het lichaam kunnen hydrolysaten met opioide activiteit verkregen worden door caseïnes met trypsine, chymotrypsine, pepsine en pancreatine te behandelen. De hydrolysaten kunnen dan aan levensmiddelen toegevoegd worden. Wel moet bij de verwerking van hydrolysaten gelet worden op procesomstandigheden zodat de hydrolysaten niet verder reageren. Tevens kunnen de hydrolysaten smaak afwijkingen geven. Opioid antagonisten, bijvoorbeeld Naltrexone en Nalexone, blokkeren de opioid receptoren. Ze hebben een invloed op de voedselinname via de voedselgewaarwording. Als er veel geconsumeerd is, komen opioid antagonisten vrij waardoor de smakelijkheid van het voedsel verminderd wordt. Door de verminderde smakelijkheid zal minder geconsumeerd worden, afhankelijk van het type voedingsstof dat geconsumeerd wordt.
Het is dus zeer goed mogelijk om peptiden te maken die de eetlust zullen remmen en deze aan levensmiddelen toe te voegen al moet hier wel gelet worden op de procesomstandigheden. Het gebruik van additieven in levensmiddelen is echter wel aan strenge regels gebonden.
Inhoudsopgave
Voorwoord 2
Samenvatting 3
Inhoudsopgave 4
1. Inleiding 5
2. Serotonine 7
2.1. Tryptofaan 7
2.2. Serotonine synthese 7
2.3. Werking van serotonine en tryptofaan 8
2.3.1 Werking van serotonine 8
2.3.2. Werking van tryptofaan 9
2.3.3. Beschikbaarheid van tryptofaan in de voeding 11
2.3.4. Beschikbaarheid van serotonine in de voeding 11
2.4. Toevoegen van tryptofaan of serotonine aan levensmiddelen 12
3. Opioid Peptiden 13
3.1. Opioid agonisten 13
3.2. Opioid antagonisten 14
3.3. Beschikbaarheid van opioiden in de voeding 15
3.4. Toevoegen van opioiden aan levensmiddelen 18
4. Discussie en Conclusie 19
Literatuur 21
1. Inleiding
Mensen moeten eten om te kunnen leven maar wat ze eten is afhankelijk van biologische en maatschappelijke factoren. Die maatschappelijke factoren zorgen ervoor dat ons voedingspatroon in de loop der jaren sterk is veranderd. Het pakket van voedingsmiddelen is steeds uitgebreider geworden. Door het gebruik van het vuur kwamen er meer voedingsmiddelen ter beschikking van de mens en toen de mens gewassen ging cultiveren, ontstond er een meer constant aanbod van voedsel. Verder heeft de industriële revolutie een grote invloed op het voedselpatroon van de mens gehad. Het eten moest makkelijk, goedkoop en houdbaar zijn en steeds meer luxe producten kwamen in ieders bereik.
Er is nu in de westerse wereld geen probleem meer met de beschikbaarheid van voedsel. Er is een ander probleem ontstaan. Vanaf de jaren '60 is de energieopname door eiwit, vet en alcohol duidelijk toegenomen ten koste van de consumptie van koolhydraten (Den Hartog, 1994). Mede daardoor hebben meer en meer mensen te maken met overgewicht en de daaraan gerelateerde welvaartsziekten. Om overgewicht tegen te gaan zijn de afgelopen jaren veel producten ontwikkeld met een lagere energie-inhoud. In plaats van laag energetische producten, kan overgewicht ook voorkomen worden door minder te eten (symtoombestrijding). Nu is de vraag hoe ervoor gezorgd kan worden dat mensen minder gaan eten, met andere woorden hoe kan de eetlust geremd worden? Eén van de mogelijkheden is om bioactieve peptiden aan het voedsel toe te voegen. In deze literatuurstudie is gekeken naar een aantal eetlustremmende peptiden, in welke producten komen ze voor, wat hun werkingsmechanisme is en hoe ze de eetlust verminderen.
Er zijn in de literatuur veel eiwitten beschreven die de eetlust kunnen remmen. Naast deze eiwitten zijn er ook een aantal hormonen die invloed uitoefenen op de voedselregulatie.
Somatostatine is een belangrijk hormoon dat de afgifte van het groeihormoon remt. Daarnaast remt het de afgifte van insuline en glucagon. Daardoor wordt er minder glucose in de lichaamscellen opgenomen (Patel, 1987). Somatostatine speelt een rol bij de nutriënt homeostasis (handhaven van nutriënt evenwicht) van het lichaam. Als de concentratie somatostatine verhoogd is, wordt de afgifte van het groeihormoon geremd en zal er geen gewichtstoename optreden (Buttery en Dawson, 1990).
Cholecystokinine (CCK) komt overal in het lichaam voor. Het heeft in het centrale zenuwstelsel een functie als neurotransmitter en in het bloed functioneert het als hormoon (Rehfeld, 1980). Er bestaan verschillende hypotheses over het mechanisme waarop CCK een eetlust remmende werking kan hebben. Eén hypothese is dat als de maag zich vult, de CCK-receptoren in de maag een signaal aan het verzadigingscentrum in de hypothalamus geven. Door de verzadiging zal men stoppen met consumeren (Rehfeld, 1980). Maar uit een onderzoek van Baldwin et al.(1982) en uit een onderzoek van Pekas (1990) blijkt dat indien CCK intraveneus toegediend wordt aan varkens of ratten, die beesten minder voedsel consumeren. Bij deze hypothese spelen de receptoren in de maag geen enkele rol. Er is echter nergens gerapporteerd dat specifieke voedselcomponenten invloed zouden hebben op het werkingsmechanisme van CCK.
Gastrine is een hormoon dat een grote verwantschap heeft met CCK. Het zorgt ervoor dat de maagsamentrekkingen plaatsvinden en dat er maagsappen uitgescheiden worden (Brook en Marshall, 1996). Dus ook op de werking van gastrine is geen invoed van voedselcomponenten te verwachten.
Thyrotropine releasing hormoon (TRH) stimuleert de synthese en afgifte van TSH (Thyroid stimulating hormone). TSH speelt een rol bij de afgifte van thyroide hormonen. Op de lange termijn heeft TSH een positief effect op de eiwit synthese (Brook and Marshall, 1996). Er zijn experimenten uitgevoerd waarbij gekeken werd naar het effect van TRH op de lichaamssamenstelling. Er werd gevonden dat het aantal vetkussentjes bij de kippen die TRH toegediend kregen duidelijk gereduceerd was (Mitchell and Burke, 1993). Dit hormoon heeft dus eigenlijk meer invloed op het metabolisme dan op de eetlust.
Leptine (of obesity gene related peptide (OBGRP)) is een hormoon dat een rol speelt bij de vethuishouding van het lichaam. Als er recombinant leptine aan een persoon wordt toegediend, neemt de voedsel inname af, wordt het energieverbruik verhoogd en wordt het insuline niveau verlaagd. Leptine werkt via een receptor binding. Er is echter geen peptide bekend met een vergelijkbare structuur als leptine. In ons voedsel zitten dus geen peptiden die de voedselinname kunnen beïnvloeden via hetzelfde mechanisme als leptine (Verploegen et al ., 1997).
Van serotonine en opioid peptiden (bijvoorbeeld naltrexone) zijn eetlust remmende werkingen beschreven die wel door voedingscomponenten beïnvloed kunnen worden.
Zoals duidelijk is, zijn er veel hormonen in het menselijk lichaam betrokken bij de eetlust regulatie. Er zijn echter maar een paar peptiden die via het voedsel invloed uit kunnen oefenen op de hoeveelheid voedsel dat wordt geconsumeerd. In de volgende hoofdstukken zal worden ingegaan op de werking van opioide peptiden en op de werking van serotonine en hoe de voeding aan de effecten van deze peptiden bij kan dragen.
2. Serotonine
2.1. Tryptofaan
Tryptofaan is één van de essentiële aminozuren voor de mens (de Graaf
et al ., 1993). Deze essentiële aminozuren moeten uit de voeding worden opgenomen. Aminozuren worden via de darmwand opgenomen en komen dan in het bloed terecht. Tryptofaan is het enige aminozuur dat bij de mens aan serum albumine in het bloed bindt en zo getransporteerd kan worden. Daarnaast wordt tryptofaan in het bloed getransporteerd via een carrier mechanisme. Deze carrier transporteert alle grote neutrale aminozuren (LNAA); leucine, isoleucine, valine, fenlalanine, tyrosine en methionine. Tussen deze neutrale aminozuren vindt competitie plaat om de receptorplaatsen (Herderich en Gutsche, 1997).
De LNAA's worden naar de hersenen getransporteerd. In de hersenen kan tryptofaan omgezet worden in serotonine nadat tryptofaan de bloed-hersenbarrière gepasseerd is. Hiervoor zijn speciale transportkanalen aanwezig die alle LNAA's transporteren. Ook voor deze kanalen geldt dat er competitie tussen de aminozuren plaats vindt. De verhouding tussen tryptofaan en de LNAA geeft aan hoeveel tryptofaan opgenomen kan worden. Is er veel tryptofaan aanwezig dan is de verhouding hoog en zal er veel tryptofaan de bloed-hersenbarrière passeren (Fernstrom en Fernstrom, 1995). De hoeveelheid tryptofaan die in het bloed aanwezig is, wordt bepaald door de aminozuursamenstelling van de voeding. Hier wordt in hoofdstuk 2.3.2 op ingegaan.
2.2. Serotonine synthese
Nadat tryptofaan in de hersenen is opgenomen, kan het omgezet worden in andere componenten via onder andere de kyurenine route en de serotonine route. Via de kyurenine route wordt 95% van alle tryptofaan omgezet in stoffen als quinolinaat, antranilaat en kyunureniaat (Herderich en Gutsche, 1997). Slechts 1% van alle tryptofaan wordt via de serotonine route omgezet in serotonine (figuur 1).
Tryptofaan wordt eerst op de C5-positie gehydroxyleerd tot 5-hydroxytryptofaan (5-HTP) wat daarna gedecarboxyleerd wordt tot serotonine (Herderich en Gutsche, 1997).
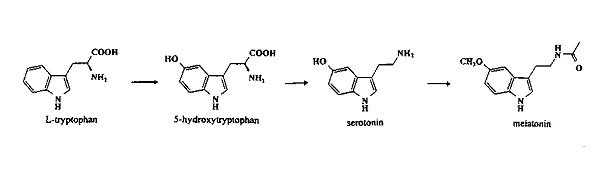
Figuur 1: Synthese route van serotonine vanuit tryptofaan (Herderich en Gutsche, 1997)
Serotonine heeft in het lichaam diverse functies. In hoofdstuk 2.4 wordt de functie van serotonine in de voedselopname regulatie besproken worden. Verder speelt serotonine een rol bij de gemoedstoestand bij de mens. Als de serotonine concentratie laag is dan treden er gedragsverschijnselen van depressie op (Smith
et al ., 1997). Daarnaast speelt serotonine een rol bij de bloedstolling. Serotonine zorgt ervoor dat bloedvaten vernauwen zodat er minder bloed aangevoerd wordt (Fox, 1996).
2.3. Werking van serotonine en tryptofaan
2.3.1 Werking van serotonine
Serotonine is een regulerende stof (neurotransmitter) die betrokken is bij de voedselregulatie. Serotonine heeft invloed op de energiebalans van het lichaam en het reguleert het regelmatigheidpatroon van de voeding door beïnvloeding van de verzadiging. Dit laatste gebeurt door het activeren van de verzadigingsneuronen in de hypothalamus. Serotonine gaat hier een antagonistische interactie aan met de receptoren voor noradrenaline en norpinefrine. De macronutriënt keuze van een voeding wordt door serotonine beïnvloed (zie hoofdstuk 2.3.2).
Door de concentratie serotonine in de hersenen kunstmatig te variëren, kan aangetoond worden dat met de concentratie ook het verzadigingsgevoel fluctueert en dat de hoogte van de concentratie ook van invloed is op de macronutriënt keuze (Cangiano
et al ., 1992). En zoals ook al eerder vermeld is, heeft serotonine ook invloed op de gemoedstoestand van de mens (Smith
et al ., 1997).
Nadat aangetoond was dat serotonine de eetlust kon remmen, is er een studie uitgevoerd naar de lange termijn effecten van serotonine. Aan een groep vrouwen werd 5- hydroxytryptofaan (5-HTP, precursor van serotonine) toegediend en vervolgens werd gekeken naar de voedselopname en de gewichtsverandering van de proefpersonen. Toedienen van 5-HTP had tot resultaat dat de totale energie opname en koolhydraat opname verminderden. Dat leidde tot een significant gewichtsverlies (Cangiano
et al ., 1992). Omgekeerd werd ook aangetoond dat een laag calorisch dieet resulteerde in een verlaging van de hoeveelheid serotonine in de hersenen doordat er minder tryptofaan aanwezig was (Wolfe
et al ., 1996).
2.3.2. Werking van tryptofaan
De maaltijdsamenstelling is van invloed op de verhouding van tryptofaan (Trp) en grote neutrale aminozuren (LNAA). In een onderzoek van Fernstrom en Fernstrom (1985) werd gekeken naar de invloed van de samenstelling van het voedsel op de samenstelling van de volgende maaltijd. Na een eiwit rijke maaltijd bleek dat de verhouding Trp/LNAA kleiner werd. In normale eiwitrijke voeding zitten meer LNAA's dan tryptofaan en dus wordt er niet genoeg tryptofaan in de hersenen opgenomen om extra serotonine te produceren. De evenwichtsconcentratie serotonine blijft gehandhaafd (Fernstrom en Fernstrom, 1995).
Na een koolhydraat rijke maaltijd wordt er insuline gesecreteerd. Insuline zorgt ervoor dat glucose in cellen wordt opgenomen (Fox, 1996), maar het heeft ook effect op de aminozuursamenstelling van het bloed. Het zorgt ervoor dat de concentratie LNAA's daalt en de concentratie tryptofaan naar verhouding hoger wordt doordat de LNAA's door spiercellen opgenomen worden. Er ontstaat dus een gunstiger verhouding Trp/LNAA en er wordt meer tryptofaan in de hersenen opgenomen, zie ook figuur 2 (Fernstrom en Wurtman, 1972).
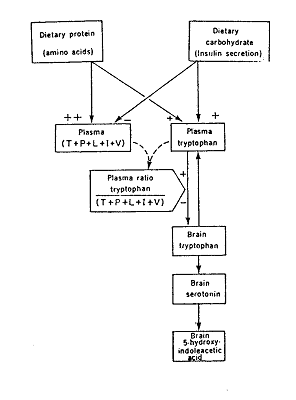
Figuur 2: Invloed van eiwitten en koolhydraten op concentratie serotonine in de hersenen van een rat. T= tyrosine, P= phenylalanine, L= leucine, I= isoleucine, V= valine, - = reductie van niveau, + = toename van niveau, ++ = sterke toename niveau (Fernstrom en Wurtman, 1972).
De effecten worden anders als er twee maaltijden achter elkaar gegeten worden. De vorige maaltijd heeft effect op de opname van tryptofaan. Als er eerst een koolhydraat rijke maaltijd is genuttigd, is de verhouding Trp/LNAA gestegen. Als de tweede maaltijd nu ook voornamelijk uit koolhydraten bestaat zal er geen ander effect dan het hierboven beschreven effect optreden. Als de tweede maaltijd voornamelijk uit eiwitten bestaat zal de verhoging van de verhouding Trp/LNAA te niet gedaan worden omdat de tryptofaan-inhoud van veel voedingsmiddelen niet toerijkend is om de hoge Trp/LNAA verhouding in stand te houden.
De mate waarin compensatie van het effect van koolhydraten (stijging Trp/LNAA verhouding) optreedt, is afhankelijk van het eiwit percentage. Pas als het percentage boven de 12% komt, wordt de verlaging van de verhouding Trp/LNAA significant.
Als er een eiwitrijke maaltijd na een eiwitrijke maaltijd gegeten wordt zal de verhouding Trp/LNAA niet veel meer veranderen. De verhouding is al zo laag dat er geen extra serotonine gevormd wordt dus zal geen merkbaar effect te zien zijn. Als er een koolhydraatrijke maaltijd gegeten wordt na een eiwitrijke maaltijd hangt effect af van de eiwitconcentratie van de eerste maaltijd. Als er weinig eiwit aanwezig was in de eerste maaltijd, zal de verlaging van de verhouding Trp/LNAA omgezet worden in een verhoging. De concentratie tryptofaan in de hersenen stijgt waardoor er meer serotonine geproduceerd wordt. Bij een eiwit concentratie van meer dan 12% is de verhouding Trp/LNAA te laag om door insuline zover verhoogd te worden dat extra tryptofaan door de hersenen wordt opgenomen.
De hierboven beschreven effecten treden alleen op als de tijd tussen de eetmomenten niet te lang is. Door het lichaam zal door het normale metabolisme de verhouding weer op een evenwichtswaarde worden ingesteld. Bij ratten is gevonden dat na drie uur geen effect meer te zien is. Bij de mens zal deze periode langer zijn dan 3 uur omdat de mens een langzamer metabolisme heeft dan de rat.
De hierboven beschreven effecten laten zien dat er een negatieve feedback bestaat die de keuze voor een maaltijd met bepaalde samenstelling reguleert. Als er een koolhydraatrijke maaltijd gegeten is, gaat de concentratie serotonine omhoog. Deze hoge serotonineconcentratie zorgt ervoor dat de volgende maaltijd zo gekozen wordt dat er veel eiwitten in de voeding aanwezig zijn (Fernstrom en Fernstrom, 1995).
Naast het onderzoek gedaan door Fernstrom en Fernstrm (1995) is door Markus en zijn medewerkers (2000) een onderzoek uitgevoerd naar de invloed van a-lactalbumine, een tryptofaan rijk wei-eiwit, op de Trp/LNAA verhouding. In vergelijking met een caseïne dieet, werd een verhoging van het gehalte Trp/LNAA van 48% gevonden bij proefpersonen die een dieet rijk aan a-lactalbumine kregen. Dit impliceert dat er meer tryptofaan beschikbaar is voor opname in de hersenen en voor omzetting naar serotonine (Markus
et al , 2000).
2.3.3. Beschikbaarheid van tryptofaan in de voeding
Tryptofaan is één van de essentiële aminozuren en dient dus in voldoende mate in onze voeding aanwezig te zijn. Veel producten bevatten tryptofaan maar eieren, melk, vlees, sojabonen, aardappelen en granen als tarwe en rijst zijn producten met een relatief hoog tryptofaangehalte.
Maar tryptofaan is niet stabiel in levensmiddelen. Tryptofaan, vrij of gebonden in een peptide, is erg gevoelig voor oxidatie door zuurstof, waterstof peroxide, organische peroxides en peroxyzuren. Afhankelijk van het oxiderende agens ontstaan verschillende reactie producten (onder andere kynurenines (Damodaran,1996)) die niet meer omgezet kunnen worden naar serotonine. Verder is foto-oxidatie een route waarlangs tryptofaan geoxideerd wordt. Er moet dan wel een oxiderend agens, bijvoorbeeld riboflavine, aanwezig zijn. In aardappelen, granen en rijst is erg weinig riboflavine aanwezig en zal er ook minder foto-oxidatie optreden. Ook in hele eieren zal er geen foto-oxidatie optreden omdat het licht niet door de schaal komt. De foto-oxidatie verloopt het beste onder anaërobe omstandigheden. De bovengenoemde tryptofaan-rijke producten worden meestal niet onder anaërobe omstandigheden verpakt. Ook andere aminozuren kunnen onder invloed van licht foto-oxidatie ondergaan. Maar de affiniteit voor oxidatie verschilt per aminozuur. Methionine en cysteine reageren beide sneller dan tryptofaan dus als deze aminozuren aanwezig zijn dan zal tryptofaan minder snel oxideren en dus beschikbaar blijven voor de omzetting naar serotonine (Damodaran, 1996).
Tijdens de Maillard-reacties reageren tryptofaanmoleculen met suikermoleculen. Maillard-reacties verlopen voornamelijk bij een verhoogde temperatuur. Tijdens deze reactie ontstaan wel een aantal componenten die bijdragen aan de aroma vorming (Damodaran, 1996). In de Pictet-Spengler reactie reageert tryptofaan met een aldehyde onder de vorming van b-carbolines (Herderich en Gutsche,1997).
Als tryptofaan bevattende peptiden gekookt of verhit worden of als de aminozuren gepyroliseerd worden, kunnen heterocyclische aromatische aminozuren ontstaan. Deze heterocylische aminen zijn mutageen en daarom niet wenselijk in het product (Herderich en Gutsche,1997). Het moge duidelijk zijn dat als tryptofaan reageert via een van de boven genoemde reacties, tryptofaan niet meer beschikbaar is voor de omzetting naar serotonine.
2.3.4. Beschikbaarheid van serotonine in de voeding
Ook in een aantal planten wordt serotonine uit tryptofaan gevormd. Als gevolg daarvan is er een aanzienlijke hoeveelheid serotonine in sommige vruchten aanwezig. In banaan, ananas en walnoten komen hoeveelheden tot 280 mg serotonine per kg voor. In andere producten wordt zeer weinig serotonine gevonden (minder dan 5 mg/kg) (Herderich en Gutsche, 1997).
2.4. Toevoegen van tryptofaan of serotonine aan levensmiddelen
Serotonine en tryptofaan kunnen dus zonder al te veel bezwaren toegevoegd worden aan voedingsmiddelen. Toch is er wel enige belemmering bij het toepassen van deze stoffen. Niet alle stoffen mogen zo maar toegevoegd worden. Stoffen mogen wel aangevuld worden tot oorspronkelijk niveau als door processing een gedeelte afgebroken is. Ook mogen stoffen die door de EU zijn goedgekeurd toegevoegd worden, de zogenaamde E-nummers. Het is dus niet toegestaan om aan elke willekeurig product tryptofaan toe te voegen. Er zal toestemming gevraagd worden waarbij duidelijk moet zijn dat er bij toevoegen van tryptofaan geen gevaar voor de gezondheid ontstaat. Als tryptofaan toegevoegd mag gaan worden, moet bij de productie wel opgelet worden dat de tryptofaan niet gaat reageren. De consumptie van tryptofaan kan gemakkelijk verhoogd worden door producten te eten die rijk zijn aan tryptofaan en door de verliezen van tryptofaan tijdens de bereiding te voorkomen.
3. Opioid Peptiden
Een tweede groep van peptiden die betrokken zijn bij de eetlustremming zijn de opioid peptiden. Deze peptiden doen dienst als neurotransmitter (Fox, 1996). Ze zijn in te delen in opioid agonisten en opioid antagonisten.
3.1. Opioid agonisten
In een groot aantal levensmiddelen zijn peptiden aangetroffen met een hormoonachtige werking. Deze bioactieve peptiden worden in de dunne darm opgenomen en kunnen daarna aan specifieke receptoren binden. In onder andere melk (van humane en dierlijke oorsprong) zijn een aantal opioid agonisten aangetoond: casomorphines en a- en b-lactorphines. Vooral over b-casomorphines, gevormd uit b-caseïne (b-CM), is veel bekend. Ook tarwegluten bevatten sequenties die een opioide activiteit bezitten (Froetschel, 1996).
Opioid agonisten worden uit het voedsel opgenomen. In de maag wordt door pepsine de eiwitten (onder andere caseine) afgebroken tot peptiden (casomorphines, exorphines en lactorphines). Sommige van deze peptiden hebben direct een opioide activiteit, anderen zijn in de vorm van pro-peptide aanwezig. In de darmwand worden de pro-peptiden niet verder afgebroken. Ze zijn resistent tegen de werking van trypsine, chymotrypsine, carbopeptidase A en B en leucine-aminopeptidase (Paroli, 1988; Froetschel, 1996).
De opioid peptiden moeten opgenomen worden. Er is weinig bekend over het precieze opname mechanisme maar men verondersteld dat de pro-peptiden worden opgenomen of dat de pro-peptiden door enzymen in de darmwand (o.a. dipeptidyl-peptidase (DPP-IV)) gesplitst worden tijdens de opname vanuit de darm in het bloed (Froetschel, 1996). Om de receptoren in de hersenen te kunnen bereiken moet de bloed-hersenbarrière gepasseerd worden. Opioid peptiden hopen zich in de hersenen op vooral op plaatsen waar de bloed-hersenbarrère het makkelijkst te passeren is. Het probleem van deze theorie is dat er nog geen publicaties over peptide transportsysteem voor de bloed-hersenbarrière zijn. Daarom wordt er ook nog wel uitgegaan van een theorie dat er sprake is van prikkeloverdracht via een second-messenger systeem (Paroli, 1988). De exorphines (bepaald type opioid agonist) die niet opgenomen worden, worden door de aan de C-kant van proline splitsende enzymen snel afgebroken.
Opioid peptiden worden ingedeeld in 3 verschillende groepen afhankelijk van de effecten die verschillende receptoren hebben:
De eerste groep bestaat uit peptiden die aan de m-receptoren binden. Deze hebben een pijnstillend effect, verlagen de ademhalingsfrequentie en veroorzaken verstopping van de darm (Froetschel, 1996). De m-receptor heeft zenuwbanen naar de hypothalamus en de thalamus en er kan dus gezegd worden dat deze receptor een neuro-endocrine werking heeft. De opioiden die uit humaan of dierlijk b-caseïne worden gevormd, hebben de meeste affiniteit met m-receptoren (Paroli, 1988).
De tweede groep die bestaat uit peptiden die aan de d-receptoren binden, hebben een overheersend effect op perifere weefsel, met name op de mucosa van het spijsverteringskanaal en op de dunne darm. Verder hebben ze invloed op de emotionele toestand van de mens (Paroli, 1988).
De laatste groep is de groep van peptiden die aan de k-receptoren bindt en naast een pijnstillend effect ook een rol spelen bij de voedselopname en waterophoping in het lichaam. Tevens kunnen ze een verdovend effect hebben (Froetschel, 1996).
De opioid peptiden hebben de volgende effecten op het lichaam. Als eerste zullen opioid peptiden de mobiliteit van de darm verminderen. Dit houdt in dat doordat de darm minder bewegingen maakt, het voedsel langer in de darm verblijft. Hier liggen neurale en perifere mechanismen aan te grondslag. De k-receptoren lijken verantwoordelijk te zijn voor de opioid gecontroleerde peristatieke periodiciteit van de darmen. Doordat de exogene opioid peptiden met de receptoren binden, komt er endogeen opioid peptide (acetylcholine) vrij.
Het binden van opioid peptiden aan de receptoren kan ook leiden tot hyperpolarisatie van het membraan en dan wordt er geen acetylcholine uitgescheiden. Dit heeft het pijnstillend effect.
Opioid peptiden intensiveren ook de afgifte van insuline en somatostatine. De productie en afgifte van insuline wordt gestimuleerd zonder dat er een verhoogde bloedsuikerspiegel aanwezig is (Paroli, 1988). In een experiment waarbij de bloedglucoseconcentratie kunstmatig op niveau werd gehouden, bleek dat hyperinsulemie ontstond zonder dat er sprake was van hypoglycemie. Er is gebleken dat de voedselopname vermindert en lichaamsgewicht afneemt (Froetschel, 1996).
Opioid peptides spelen een rol bij de voedselopname. Daarbij zijn opioiden die op de k-receptoren binden betrokken. In een studie met ratten bleek, dat bij injectie van morficeptine in de hersenen, de voedselopname afnam. De k-receptoren worden niet door exorphines uit gluten gestimuleerd. Ook de m-receptoren zijn bij de voedsel opname betrokken. Zij zouden bij de ontwikkeling van een anorexia een rol spelen (Paroli, 1988).
3.2. Opioid antagonisten
Opioid antagonisten zijn peptiden die een tegenovergesteld effect hebben dan de opioide agonisten. Ze binden aan de receptoren voor de agonisten (Nalexone aan de d-receptoren) zonder daar een effect te hebben. Soms verhinderen ze een effect of ze concurreren met de agonisten zodat de effecten verdwijnen. Opioid antagonisten verlagen de hoeveelheid voedsel die wordt opgenomen doordat als het lichaam verzadigt raakt aan voedingsstoffen, de herkenning van de smakelijkheid van het voedsel te verminderen. Onderscheid tussen smakelijk en niet smakelijk kan niet meer gemaakt worden omdat er geen eetlust wordt opgewekt als er smakelijk voedsel wordt aangeboden. De antagonisten grijpen dan ook het meest aan op de m-receptoren in de hersenen. De nu bekende opioide antagonisten zijn in staat om de bloed-hersen barrière te passeren (Froetschel, 1996).
De meest bekende opioide antagonisten zijn naloxone en naltrexone. Naar de effecten van naltrexone op de aangenaamheid van voedsel is onderzoek uitgevoerd door Yeomans en Gray (1997). Er wordt uitgegaan van twee regulerende feedbackloops die een rol kunnen spelen bij de regulatie van de voedselopname. Er bestaat een positieve feedback loop die eetlust oproept als er een stimulus aanwezig is (behoefte aan nutriënten) en een negatieve feedbackloop die zorgt dat de eetlust verminderd wordt als er verzadiging optreedt (Yeomans, 2000). Men gaat ervan uit dat naltrexone ingrijpt in de positieve feedbackloop door de relatie tussen smakelijkheid van het voedsel en de eetlust te modificeren (Yeomans en Gray, 1997).
Uit experimenten waarbij werd gekeken naar de voedselopname van twee verschillende maaltijden die in energie- en nutriënteninhoud verschilden, bleek dat de aangenaamheid van het voedsel en de verzadiging gerelateerd zijn aan de voedselopname. Proefpersonen die naltrexone toegediend hadden gekregen, werden vergeleken met proefpersonen die een placebo toegediend kregen. Het bleek dat mensen die naltrexone toegediend hadden gekregen, een significante reductie van de energieopname lieten zien. Van de hoog koolhydraatmaaltijd en van de hoog vetmaaltijd werd minder geconsumeerd. Naltrexone vermindert dus ook de overall voedselopname.
Naarmate er meer voedsel geconsumeerd was, werd de aangenaamheid van het voedsel lager. De proefpersonen stopten met eten als er een bepaalde onaangenaamheid was ontstaan. Bij de proefpersonen die naltrexone toegediend hadden gekregen, was de aangenaamheid van het voedsel lager en werd dus ook eerder gestopt met eten.
Hoe meer voedsel er geconsumeerd was, hoe hoger de verzadiging van de proefpersonen. Als er naltrexone toegediend was aan proefpersonen die een hoog vetmaaltijd kregen was er geen significant effect van naltrexone waar te nemen. Bij de groep proefpersonen die een hoog koolhydraatvoeding kregen, was wel een snellere verzadiging als gevolg van naltrexone waar te nemen.
Het resultaat is dat naltrexone de voedselopname en de smakelijkheid van het voedsel verlaagt door de aangenaamheid te verminderen (Yeomans en Gray, 1997).
3.3. Beschikbaarheid van opioiden in de voeding
Hormoonachtige peptiden, waaronder de opioiden zijn in eiwitrijke levensmiddelen aangetroffen. In onder andere melk, bloed, granen en speeksel zijn opioiden aanwezig. Vooral over het voorkomen van opioiden in melk is veel bekend. Melk bevat caseïnes en wei-eiwitten. Uit caseïnes worden door hydrolyse opioid agonisten gevormd als b-casomorphines en lactorphines (Froetschel, 1996). Peptiden die in wei voorkomen, zijn vaak opioide antagonisten (Pihlanto-Leppälä et al ., 1994).
Melk is op dit moment de meest belangrijke bron van opioide peptiden. De eerste opioide peptiden die gekarakteriseerd werden, zijn b-1,5-casomorfine en b-1,7-casomorfine, beide residuen van b-caseïne. Ook fragmenten van a-caseïne en k-caseïne hebben opioide activiteit.
In figuur 3 zijn de aminozuurvolgordes van de peptiden gegeven.
a-casomorphine:
Arg-Tyr-Leu-Gly-Tyr-Leu-Glu
b-1,7-casomorfine:
Tyr-Pro-Phe-Pro-Gly-Pro-Ile
b-1,5-casomorfine:
Tyr-Pro-Phe-Pro-Gly
k-casomorfine:
Ser-Arg-Tyr-Pro-Ser-Tyr
Figuur 3: Aminozuurvolgordes van opioid peptiden uit caseïnes (Pihlanto-Leppälä et al ., 1994)
De caseïnes worden in het maagdarmkanaal gehydrolyseerd en opgenomen. Als er eenmaal opioide peptiden gevormd zijn, zijn deze resistent tegen proteolyse omdat ze erg hydrofoob zijn door de aanwezigheid van proline. Hierop vormt a-casomorphine een uitzondering. Men heeft nu geprobeerd om peptiden met opioid werking uit caseïne te verkrijgen door hydrolyse met trypsine, chymotrypsine, pepsine en pancreatine. Trypsine heeft de meeste affiniteit voor de carboxylbinding tussen arginine en lysine. Pepsine heeft de meeste affiniteit voor de hydrolyse van bindingen met de amino- of carboxylgroep van aromatische aminozuren (Tyr en Phe) of met de carboxylgroep van leucine, asparginezuur of glutaminezuur (Pihlanto-Leppälä et al., 1994).
Het opioid peptide a-casomophine (a-CM) komt overeen met de aminozuren 90-96 van a-caseïne. Bij de hydrolyse van a-caseïne worden alleen peptiden kleiner of langer dan a-CM 90-96 gevormd. De werking van de hydrolyse enzymen meegenomen, lijkt het het meest voor de hand liggend dat a-CM 90-96 vrijgemaakt wordt door pepsine (Pihlanto-Leppälä et al ., 1994).
Het opioid peptide b-casomorphine bestaat uit de aminozuren 60 tot 66 van b-caseïne. Er wordt een peptide gevormd, bestaande uit aminozuren 59-66, als er na een hydrolyse met pepsine, een hydrolyse met trypsine, chymotrypsine + trypsine of met pancreatine wordt uitgevoerd. Echter, er is een hydrolyse van de binding tussen aminozuur 59 en 60 nodig om opioid werking te krijgen. In het darmkanaal wordt deze binding door carboxypeptidase Y gehydrolyseerd maar dit enzym hydrolyseert ook de binding tussen aminozuur 65 en 66. Het is gebleken dat het nu verkregen pentapeptide een hogere opioide werking heeft dan b-casomorfine. Het b-casomorfine 59-68 dat door hydrolyse door pepsine en trypsine gemaakt kan worden zal tijdens de vertering afgebroken worden tot het gewenste b-casomorfine 60-66.
Het k-casomorfine bestaat uit de aminozuren 33 tot 38 van het k-caseïne. Dit opioide peptide wordt gevormd als k-caseïne door pepsine gehydrolyseerd wordt. Hier wordt dus direct het gewenste peptide vrijgemaakt. Overigens is gebleken dat als k-casomorphine gemethyleerd wordt, het een grotere opioid activiteit heeft (Pihlanto-Leppälä et al ., 1994). Nadat de peptiden zijn gevormd moeten ze van de overige componenten gescheiden worden. Hier zijn de chromatografische methoden erg geschikt voor.
In de onderstaande tabel (tabel 1) staan de opbrengsten opioid peptide uit de caseïnes. Bij het praktische gebruik van de resultaten moet er wel rekening gehouden worden met het feit dat er in het menselijke maag-darm kanaal andere omstandigheden heersen als in deze in vitro experimenten. Factoren als de pH, de tijd die voor vertering beschikbaar is, enzymmengsels en inhiberende factoren zijn in de in vitro experimenten goed gedefinieerd en in vivo is dat minder het geval (Pihlanto-Leppälä et al ., 1994). Deze getallen verschillen ook nog wel eens met andere literatuur. De opbrengst hangt natuurlijk ook af van de vitaliteit van de enzymen en van de hydrolyseduur.
Tabel 1: De hoeveelheid opioide peptide die uit één gram caseïne gevormd kan worden (Pihlanto-Leppälä et al ., 1994)
| Opioid peptide |
Opbrengst (mg peptide/g caseïne) |
| a-casomorfine |
9,3 |
| b-casomorfine |
15,1 |
| k-casomorfine |
10,7 |
Hoewel het dus goed mogelijk lijkt om casomorfines uit caseïne te maken, zijn er nog wel wat problemen bij de toepassing van deze peptiden in levensmiddelen. Zo is de activiteit van alle verschillende peptiden niet gelijk. Een vier aminozuur lang peptide, wat een gedeelte van b-casomorfine is, heeft ook enige opioide activiteit.
Het nadeel van b-casomorfine is dat het erg bitter is. Het is zelfs zes keer bitterder dan cafeïne. Als men het peptide aan levensmiddelen toe wil voegen moet met zeker met deze smaakafwijking rekening houden.
Verder zijn er ook aanwijzingen dat b-casomorfine aanleiding kan geven voor een allergische reactie. Als er aan kalveren binnen 6 uur na de geboorte caseïne wordt toegediend, is er immunoreactiviteit zichtbaar. Ook bij de mens en dan bij voornamelijk lactose-intoleranten, is aangetoond dat er IgG-antilichamen worden aangemaakt (Paroli, 1988). Er is in de literatuur geen melding gemaakt van allergische reacties tegen andere opioiden.
3.4. Toevoegen van opioiden aan levensmiddelen
Het is nog de vraag of het toegestaan is om caseïne-hydrolysaten aan voedingsmiddelen toe te voegen. Toevoegen van additieven is namelijk aan strenge eisen gebonden.
Technisch is het mogelijk om caseïne hydrolysaten te maken. Het nadeel van peptiden is dat als ze tijdens de verwerking in een product een hitte behandeling ondergaan, ze zullen reageren waardoor ze hun activiteit zullen verliezen. De hydrolysaten zijn in het lichaam net zo stabiel als de hydrolysaten die het lichaam zelf produceert.
4. Discussie en Conclusie
In het menselijk lichaam komen veel peptiden voor die, vaak via hormonale werking, invloed uit kunnen oefenen op de eetlust regulatie. De eetlust regulatie is daarmee een zeer complex geheel. Het maag-darmkanaal, de voedingscomponenten maar ook de gemoedstoestand van de mens hebben invloed.
In tabel 2 is samengevat welke eiwitten een invloed uit kunnen oefenen op de voedsel regulatie en op welke manier die regulatie plaats vindt, welke voedingscomponenten een invloed kunnen hebben en wat voor effect dit alles tot gevolg heeft. Twee groepen eetlustremmers kunnen onderscheiden worden, serotonine en de opioide peptiden. Serotonine wordt uit tryptofaan gesynthetiseerd en heeft invloed op het regelmatigheidspatroon van de voeding. Hierdoor wordt de consumptie verminderd. De opioide peptiden kunnen ingedeeld worden in opioid agonisten en opioid antagonisten. De opioid agonisten worden uit eiwitten gevormd en hebben een aantal effecten tot gevolg. Door verminderde peristaltiek en darmactiviteit wordt de opname van de voeding verminderd. De opioid antagonisten verminderen de smakelijkheid van de voeding waardoor de consumptie verminderd wordt.
Het lijkt technisch mogelijk om peptiden te maken met een eetlust remmende werking. Het is alleen nog de vraag of de wet dit alles toestaat. De gevonden effecten zijn klein en zijn gevonden in dier- of in in vitro studies. Het daadwerkelijke effect op de mens is dan ook nog lang niet duidelijk. Er zou nog verder naar de werking van de hormonen die een rol spelen bij de eetlustremming gekeken kunnen worden. Er zou gezocht kunnen worden naar een eiwit wat dezelfde of bijna dezelfde aminozuurvolgorde heeft als het actieve centrum van de hormonen.
De industrie doet pogingen om zodanige voedingsmiddelen te ontwikkelen dat de eetgewoonten van de mens niet veranderd hoeven worden. Beter zou het zijn dat mensen wel hun eet- en leefgewoonten aanpassen. Een afwisselende voeding en voldoende bewegen zijn altijd nog de beste manier om overgewicht te voorkomen.
Literatuur
Baldwin, B.A., T.R. Cooper, R.F. Parrott, 1982, Effect of cholestocystokinin octapeptide on food intake in pigs, Proceedings of the Nutrition Society, 41, 119-121
Brook, C.G.D., N.J. Marshall,1996, Essential Endocrinology, 3de editie, Blackwell Science, United Kingdom, Oxford
Buttery, P.J., J.M. Dawson, 1990, Growth promotion in farm animals, Proceedings of the nutrition society, 49, 459-466
Cangiano, C., F. Ceci, A. Cascino, M. Del Ben, A. Laviano, M. Muscaritoli, F. Antonucci, F. Rossi-Fanelli, 1992, Eating behavior and adherence to dietary presciptions in obese adult subjects treated with 5-hydroxytryptophan, American Journal of Clinical Nutrition, 56, 863-867
Damodaran, S., 1996, Amino acids, peptides and proteins, In: O. R. Fennema (Ed.), Food chemistry, 3de editie, Marcel Dekker Inc., United States of Amerika, New York
Fernstrom, J.D., R.J. Wurtman, 1972, Brain serotonin content: Physiological regulation by plasma neutral amino acids, Science, 178, 414-416
Fernstrom, M.H., J.D. Fernstrom, 1995, Brain tryptophanconcentrations and serotonin synthesis remain responsive to food consumption after the ingestion of sequential meals, American Journal of Clinical Nutrition, 61, 312-319
Fox, S.I., 1996, Human Physiology, Wm. C. Brown Publishers, 5de editie, United States of Amerika, Dubuque
Froetschel, M.A., 1996, Bioactive peptides in digesta that regulate gastrointestinal function and intake, Journal of Animal Science, 74, 2500-2508
Graaf, de C., C.P.G.M. de Groot, J.C. Seidell, W.A. van Staveren, 1993, Voeding in Nederland; gezodheid, groei en ontwikkeling, Bohn Stafleu Van Loghum, Nederland/ Belgie, Houten/Antwerpen
Hartog, den A.P.,1994, Het dynamische voedingspatroon, In: Nieuwe voedingsmiddelen; biotechnologie, novel en functional foods, Stichting Bio-wetenschappen en Maatschappij, Nederland, Utrecht
Herderich, M., B. Gutsche, 1997, Tryptophan-derived bioactive compounds in food, Food Review International, 13(1), 103-135
Markus, C.R., B. Olivier, G.E.M. Pan huysen, J. van der Gugten, M.S.Alles, a. Tuiten, H.G.M. Westenberg, D. Fekkes, H.F. Koppeschaar, E.E.H.F. de Haan, 2000, The bovine protein a-lactalbumin increases the plasma ratio of tryptophan to the other large neutral amino acids, and in vulnerable subjects raises brain serotonin activity, reduces cortisol concentration, and improves mood under stress, American Journal of Clinical Nutrition, 71, 1536-1544
Mitchell, R.D., W.H. Burke, 1993, The effect of orally administered thyrotrophin-releasing hormone on growth and carcass characteristics of seven- to ten-week-old broilers, Poultry Science, 72, 1952-1960
Patel, Y.C., 1978, Somatostatin, In: Growth Hormone, Growth factors and Acromegaly, Raven Press, New York, 21-36
Paroli, E., 1988, Opioid peptides from food (the exorphins), In: G.H. Bourne (Ed.), World review of nutrition and dietetics, vol 55, Karger, 58-97
Pekas, J.C., 1990, Effect of Cholestokinin Immunisation, enhanced Food intake and Growth of Swine on Lean Yield and Carcass Composition, The Journal of Nutrition, supplement, 563-567
Pihlanto-Leppälä, A., P. Antila, P. Mäntsälä, J. Hellman, 1994, Opioid peptides produced by in-vitro proteolysis of bovine caseins, International Dairy Journal, 4, 291-301
Rehfeld, J.F., 1980, Cholecystokinin as satiety signal, International Journal of Obesity, 5, 465-469
Smith, K.A., C.G. Fairburn, P.J. Cowen, 1997, Relapse of depression after depletion of tryptophan, The Lancet, 349, 915-919
Verploegen, S.A.B.W., G. Plaetinck, R. Devos, J. vander Heyden, Y. Guisez, 1997, A human leptin mutant induces weight gain in normal mice, Federation of European Biochemical Societies Letters, 405, 237-240
Wolfe, B.E., E.D. Metzger, C. Stollar, 1996, The effect of dieting on plasma tryptophan concentration and food intake in healthy women, Physiology and Behavior, 61, 537-541
Yeomans, M.R., 2000, Rating changes over the course of meals: what do they tell us about motivation to eat?, Neuroscience and Biobehavioral reviews, 24, 249-259
Yeomans, M.R., R.W. Gray, 1997, Effects of naltrexone on food inake and changes in subjective appetite during eating: Evidence for opioid involvement in the appetizer effect,Physiology and behavior, 62, 15-21